Epigenetischer Status entscheidet über Metastasierung
Wissenschaftlerinnen und Wissenschaftler vom Deutschen Krebsforschungszentrum (DKFZ) und der Medizinischen Fakultät Mannheim der Universität Heidelberg untersuchten an Mäusen, wie sich streuende Tumorzellen am Ort der Metastasierung verhalten: Einige Krebszellen beginnen sogleich, zur Metastase auszuwachsen. Andere dagegen verlassen das Blutgefäß und können dann in eine lange Ruhephase verfallen. Entscheidend dafür, welchen Weg die Krebszellen einschlagen, ist ihr epigenetischer Status. Das bestätigten auch Experimente mit Tumorzelllinien. Die Ergebnisse könnten wegweisend für neue diagnostische und therapeutische Ansätze sein.
Was macht Krebserkrankungen so gefährlich? Krebszellen, die sich vom Primärtumor absondern, gelangen in entfernte Körperregionen und wachsen dort zu Tochtergeschwülsten, Metastasen, heran. Während sich viele Primärtumoren in frühen Stadien oft gut behandeln lassen, sind Metastasen die eigentliche Gefahr. Experten schätzen, dass bei soliden Tumoren etwa 90 Prozent aller Krebstodesfälle auf das Konto der Metastasen gehen.
Bereits seit Jahrzehnten arbeiten Forscher daran, die Streuung von Tumorzellen zu verstehen und zu unterbinden. Dennoch sind die Mechanismen, die es einer Krebszelle ermöglichen, im fremden Organ zu überleben und schließlich zu einer Metastase heranzuwachsen, bislang weitgehend unbekannt.
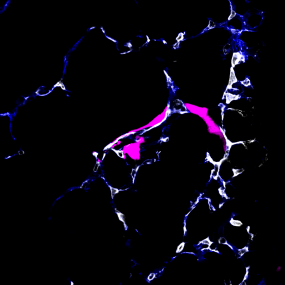
Um sich im Körper zu verbreiten, nutzen Krebszellen die Blut- oder Lymphbahnen. Wissenschaftler im DKFZ und in der Universität Heidelberg haben nun ein Verfahren entwickelt, um bei Mäusen das Verhalten wandernder Krebszellen unmittelbar bei Ankunft im metastatischen Organ – in diesem Fall der Lunge – zu beobachten.
Dabei entdeckte das Team um die beiden Erstautoren Moritz Jakab und Ki Hong Lee, dass manche Tumorzellen, sobald sie im Zielorgan angekommen sind, aus dem Blutgefäß austreten und in einen Ruhezustand fallen. Andere Krebszellen dagegen fangen direkt im Blutgefäß an, sich zu teilen und zur Metastase auszuwachsen.
Diese Entscheidung wird von den Endothelzellen gesteuert, die alle Blutgefäße von innen auskleiden. Sie schütten Faktoren des Wnt-Signalwegs aus, die den Austritt der Tumorzellen aus dem Blutgefäß fördern und damit den Ruhezustand einleiten. Schalteten die Forscher die Wnt-Faktoren aus, kam es nicht mehr zur Latenz.
Was unterscheidet ruhende von metastasenbildenden Krebszellen?
„An diesem Punkt stellte sich uns die Frage: Warum bilden einige Krebszellen sofort eine Metastase, wohingegen andere in eine Art Schlaf verfallen?", sagt Moritz Jakab. Genetisch unterschieden sich die ruhenden und die metastasenbildenden Krebszellen nicht, auch nicht in vielen anderen molekularen Aspekten.
Doch einen subtilen Unterschied konnten die Forscher nachweisen: Die Methylierung der DNA unterschied sich zwischen den beiden Zellarten. Tumorzellen, deren Erbgut weniger stark methyliert war, reagierten empfindlich auf die Wnt-Faktoren, was den Austritt aus dem Blutgefäß und Latenz zur Folge hat. Stärker methylierte Krebszellen dagegen reagierten nicht auf die Wnt-Faktoren, blieben im Blutgefäß und starteten sogleich das metastatische Wachstum.
Die DNA-Methylierung ist Teil des epigenetischen Gedächtnisses, das bei der Zellteilung an die Tochterzellen weitervererbt wird. Der Methylierungsstatus einer Zelle ist daher weitgehend stabil. Das ließ die Forscher vermuten, dass das metastatische Verhalten der Krebszellen bereits bei ihrem Austritt aus dem Primärtumor festgelegt ist.
Um diese These zu überprüfen, untersuchte das Team den DNA-Methylierungsstatus verschiedener Tumorzelllinien. Dabei fanden sie heraus, dass dieser direkt mit ihrem metastatischen Potenzial korrelierte.
„Diese Resultate sind überraschend und könnten weitreichende Folgen für die Tumordiagnostik und Therapie haben. So könnten beispielsweise bestimmte Methylierungsmuster als Biomarker genutzt werden, um Vorhersagen zu treffen, wie hoch die Last an ruhenden Krebszellen und wie wahrscheinlich damit der Rückfall nach erfolgreicher Behandlung des Primärtumors ist", sagt Studienleiter Hellmut Augustin. „Doch vorher müssen wir prüfen, ob sich natürliche Tumoren des Menschen genauso verhalten wie die verwendeten Zelllinien oder experimentellen Tumoren."
Moritz Jakab, Ki Hong Lee, Alexey Uvarovkii, Svetlana Ovchinnikova, Shubharda L Kulkarni; Sevinc Jakab, Till Rostalski, Carleen Spegg, Simon Anders, Hellmut Augustin: Lung endothelium exploits suscepible tumour cell states to instruct metastatic latency.
Nature Cancer, 2024, https://www.nature.com/articles/s43018-023-00716-7
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Beim Krebsinformationsdienst (KID) des DKFZ erhalten Betroffene, Interessierte und Fachkreise individuelle Antworten auf alle Fragen zum Thema Krebs.
Um vielversprechende Ansätze aus der Krebsforschung in die Klinik zu übertragen und so die Chancen von Patientinnen und Patienten zu verbessern, betreibt das DKFZ gemeinsam mit exzellenten Universitätskliniken und Forschungseinrichtungen in ganz Deutschland Translationszentren:
Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.