Engineering von Zellidentitäten und Krankheitsmodellen
- Zell- und Tumorbiologie
- Nachwuchsgruppe

Dr. Moritz Mall
Eines der aufregendsten Konzepte in der Biologie ist die Plastizität des Zellschicksals, die es ermöglicht, die Zellidentität zu wechseln. Diese Plastizität ist für die normale Entwicklung essentiell, allerdings gehen auch schwere Erkrankungen mit unerwünschten Veränderungen der Zellidentität einher.
Bild: Mikroskopaufnahme von aus Bindegewebszellen reprogrammierten Neuronen., © dkfz.de
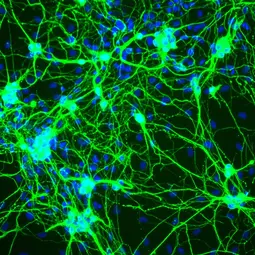
Bild: Mikroskopaufnahme von aus Bindegewebszellen reprogrammierten Neuronen., © dkfz.de
Unsere Forschung
Dedifferenzierung und die Annahme von Stammzell-ähnlichen Eigenschaften sind zum Beispiel Kennzeichen von Krebs und anomale Genexpression ist mit psychiatrischen Erkrankungen verbunden. Die Erforschung der Mechanismen, die die Zellidentität schützen, bietet daher neue Möglichkeiten, diese Krankheiten zu verstehen und zu behandeln.
Engineering von Zellidentitäten erlaubt Forschern, gezielt die Identität von Zellen zu verändern. Es ermöglicht beispielsweise, Blut oder Hautzellen von einem autistischen Patienten in funktionelle Neuronen umzuprogrammieren, um die Nervenkrankheit in der Kulturschale zu untersuchen. Diese revolutionäre Technologie ermöglicht die Analyse der Zellidentität und von Erkrankungen in Zellen, die normalerweise nicht verfügbar sind, beispielsweise Gehirnzellen von Patienten. Unsere Arbeit hat gezeigt, dass die aktive Unterdrückung unerwünschter genetischer Programme wichtig ist, um die Identität von Neuronen zu sichern. Da die beteiligten Faktoren auch mit psychischen Störungen und Krebserkrankungen des Gehirns in Verbindung stehen, untersuchen wir, ob der Verlust der neuronalen Identität zu diesen Krankheiten führen kann.
Projekte
Universitäre KI-Forschung zur Entwicklung einer Software als Medizinprodukt für die klinische Patientenversorgung am Beispiel eines Assistenzsystems für die Hautkrebsdiagnostik
Weltweit wurden im Jahr 2020 rund 325.000 Fälle des Melanoms diagnostiziert, ca. 60.000 Menschen sind letztlich daran gestorben. Während einige Melanome bereits im Frühstadium ein aggressives Verhalten zeigen, steigt die Wahrscheinlichkeit einer Metastasierung mit zunehmender Tumordicke an. Folglich ist eine schnelle und präzise Identifizierung des Melanoms von immenser Bedeutung.
Die Frühdiagnose ist jedoch selbst für erfahrene DermatologInnen nicht einfach, da sich Melanome und atypische Nävi häufig morphologisch überschneiden. Die diagnostische Herausforderung, Melanome frühzeitig zu erkennen und dabei gleichzeitig die Überdiagnose (Falsch-Positiv-Rate) zu minimieren, erfordert daher die Entwicklung fortschrittlicher Diagnosesysteme. In diesem Kontext zeigten insbesondere sogenannte Deep Neural Networks bei der Klassifizierung verdächtiger dermatoskopischer Bildaufnahmen vergleichbare oder sogar bessere Ergebnisse als erfahrene DermatologInnen.
Was bislang jedoch fehlt, ist die Translation dieser vielversprechenden Forschungsergebnisse in die klinische Routine, um einen realen Nutzen für PatientInnen, ÄrztInnen und das Gesundheitssystem zu schaffen. Vor diesem Hintergrund wird im Rahmen des sKIn-Projekts modellhaft ein auf künstlicher Intelligenz (KI) basierendes Assistenzsystem für die Melanomdiagnostik weiterentwickelt une unter Berücksichtigung der europäischen Medizinprodukteverordnung (MDR) aus der universitären Forschung zur Marktfähigkeit gebracht. Diese erklärbare KI wird weiterhin gemeinsam mit einem renommierten Dermatoskophersteller in digitale Dermatoskope integriert, um so flächendeckend eine Integration in die Hautkrebsscreening-Untersuchungen zu ermöglichen. Auf diese Weise wird eine Verbesserung der Melanomdiagnostik und somit realer Mehrwert für PatientInnen, ÄrztInnen sowie das Gesundheitssystem geschaffen.
Gleichzeitig dient das sKIn-Projekt als Blaupause für andere Forschungseinrichtungen und soll perspektivisch die Translation KI-basierter Software erleichtern. Hierfür werden konkrete Handlungsempfehlungen erarbeitet und Anregungen für die weitere Ausgestaltung regulatorischer und gesundheitspolitischer Rahmenbedingungen aufbereitet.
Heterogenität, Entwicklung und Resistenz von fusionsbedingten Sarkomen bei Jugendlichen und jungen Erwachsenen (BMBF)
Tumore entwickeln sich durch genetische und nicht-genetische Veränderungen, die zu intra-tumoraler Heterogenität (ITH) führen, einem Schlüsselfaktor für Rückfälle und Therapieresistenz. Unser Schwerpunkt liegt auf Knochen- und Weichteilsarkomen, die durch chimäre Fusionsgene verursacht werden. Diese dienen als Modellkrankheiten für die Untersuchung von ITH bei Krebserkrankungen mit definierten genetischen Triebkräften, um die Erkenntnisse in innovative Behandlungsstrategien gegen verschiedene und sich entwickelnde Tumore umzusetzen. Zu den Herausforderungen gehören begrenzte wirksame Therapien, stagnierende Behandlungsergebnisse und ein frühes Auftreten, was die Dringlichkeit unterstreicht, die Behandlungsergebnisse von Sarkom-Patienten zu verbessern. Fusionsgetriebene Sarkome (FDS) bieten aufgrund ihrer entitätsbestimmenden Fusionsgene eine einzigartige Gelegenheit, die Untersuchung von Subklonen und Plastizität zu erleichtern. FDS weisen auch eine geringe genetische Komplexität auf, was die Identifizierung von ITH-fördernden Faktoren und das Ansprechen auf eine Therapie erleichtert. Wir nutzen das Fachwissen von HEROES-AYA, einem internationalen Netzwerk für Präzisionsonkologie, und wollen FDS bei der Diagnose und während der Therapieresistenz durch modernste Analysen auf Einzelzell- und räumlicher Ebene untersuchen. In-vitro- und In-vivo-Validierungen von Schwachstellen werden in die Entwicklung von klinischen Studien über alle Altersgruppen hinweg einfließen und eine neue Ära der Präzisionsonkologie in Deutschland einläuten. Die Gruppe trägt wesentlich zu den datenwissenschaftlichen Aspekten dieses Projekts bei.
Eine Deep-Learning-Strategie für die Hochdurchsatz-Proteomik von Blutplasma und einzelnen Zellen (Heidelberg Explorer Call)
Dieses Projekt ist eine Kooperation mit dem Proteomik-Labor von Prof. Krijgsveld. Proteine sind die wichtigsten Triebkräfte für Zellfunktionen und Krankheiten. Daher ist die Proteomik ein sehr geeignetes Verfahren zur Charakterisierung von Determinanten der Zellidentität und zur Ermittlung von Biomarkern. Die derzeitige Proteomik-Technologie ist so umfangreich, dass sie Profile von Tausenden von Proteinen erstellen kann, und so empfindlich, dass sie auf einzelne Zellen zugreifen kann. Allerdings fehlt ihr der Durchsatz für eine aussagekräftige Analyse großer Probenkohorten sowohl in der Grundlagenforschung als auch in der Klinik. Daher entwickeln wir neuartige, auf künstlicher Intelligenz (KI) basierende Ansätze für die Analyse massenspektrometrischer (MS) Daten, um Plasmaproteomdaten dem klinischen Status zuzuordnen und Einzelzelldaten mit der Zellidentität zu korrelieren. Darüber hinaus werden wir Proteom-Experimente durchführen, um zu zeigen, dass dieser auf Deep Learning basierende Ansatz den Durchsatz der Plasma- und Einzelzell-Proteomanalyse erhöht. Insgesamt wird dieses Projekt einen bahnbrechenden Ansatz in der Proteomik einführen, der die Stratifizierung von Patienten und die Entdeckung von Biomarkern ermöglicht und das junge Feld der Einzelzell-Proteomik voranbringt.
Entwicklung von digitalen Biomarkern für BAP1-mutierte Krebsarten (Deutsche Krebshilfe)
Im Mittelpunkt des Projekts steht BAP1, ein Tumorsuppressor-Gen, das bei aggressiven Krebsarten häufig mutiert ist. Insbesondere BAP1-Mutationen führen zu einer erhöhten Aggressivität und Metastasierung des Tumors. Das Ziel dieses Projekts ist es, die Anfälligkeit von BAP1-Mutationen zu verstehen und sie für potenzielle Therapien bei BAP1-mutierten Krebsarten zu nutzen. Um dies zu erreichen, wurde ein kollaboratives Konsortium gebildet, dessen Teilprojekte sich auf die Bereitstellung der erforderlichen Materialien, die Prüfung spezifischer Medikamente in vitro, in vivo und in von Patienten stammenden Organoiden sowie auf die Durchführung von Biomarker-Analysen an großen menschlichen Gewebekohorten konzentrieren. Das übergeordnete Ziel besteht darin, den vorgeschlagenen Mechanismus zu validieren und potenzielle Behandlungsmöglichkeiten zu erforschen, wobei der Schwerpunkt auf der Einleitung klinischer Versuche auf der Grundlage der Ergebnisse liegt. Das Projekt integriert verschiedene Ansätze, darunter In-vitro-, In-vivo-, Ex-vivo- und klinische Probenanalysen, um BAP1-mutierte Krebsarten umfassend zu untersuchen und Strategien für eine personalisierte Medizin zu entwickeln. Innerhalb dieses Konsortiums ist unsere Gruppe für die Entwicklung digitaler Biomarker zur besseren Stratifizierung von Patienten zuständig.
Team
Ein 20-köpfiges Team aus den Bereichen Medizin, Molekularbiologie und Informatik / Data Science konzentriert sich auf die Identifikation relevanter Muster in Patientendaten sowie eine erhöhte Erklärbarkeit und Sicherheit von Entscheidungen der künstlichen Intelligenz.
- Profil anzeigen

Dr. Moritz Mall
-
Annasara Artioli
-
Matteo Gasparotto
-

Sarah Grieder-Mall
-
Catello Guida
-
Sebastian Heine
-
Anne Hoffrichter
-
Dr. Sandra Horschitz
-

Sandra Keßler
-

Tim Kindinger
-
Louis Masclef
-
Raquel Perez Fernandez
-
Sreedevi Raghu
-
Laura Rueda Gensini
-

Jana Franziska Tegethoff
-
Nathan Trausch
-
Jule Truberg
-
Ana Zovko
Zukünftige Entwicklungen
Wir verwenden hauptsächlich pluripotente Stammzellen und Engineering von Zellidentitäten, um die menschliche Entwicklung sowie Krankheiten zu rekonstruieren und zu untersuchen. Wir möchten die Mechanismen verstehen, die das Schicksal von Zellen bestimmen und aufrechterhalten, um Krankheiten zu behandeln, die mit dem Verlust der Zellidentität einhergehen. Unser derzeitiger Forschungsschwerpunkt ist die Frage, welche Rolle Zellidentitätsverluste bei malignen Erkrankungen des Gehirns und bei psychiatrischen Störungen spielen, von denen Millionen von Patienten weltweit betroffen sind und die eine große medizinische und wirtschaftliche Herausforderung für unsere Gesellschaft darstellen.

Ausgewählte Publikationen
MEOX2 homeobox gene promotes growth of malignant gliomas
A. Schönrock*, E. Heinzelmann*, B. Steffl, E. Demirdizen, A. Narayanan, D. Krunic, M. Bähr, J.W. Park, C. Schmidt, K. Özduman, M.N. Pamir, W. Wick, F. Bestvater, D. Weichenhan, C. Plass, J. Taranda, M. Mall, S. Turcan.
Trumpp, A. and S. Haas
Pro-neuronal activity of Myod1 due to promiscuous binding to neuronal genes
Q.Y. Lee*, Moritz Mall, S. Chanda, B. Zhou, K.S. Sharma, K. Schaukowitch, J.M. Adrian-Segarra, S.D. Grieder, M.S. Kareta, O. Wapinski, C.E. Ang, R. Li, T.C. Südhof, H.Y. Chang, M. Wernig
Kontaktieren Sie uns


