Molekulare Neurogenetik
- Zell- und Tumorbiologie

Dr. Haikun Liu
Abteilungsleiter
Die Abteilung für Molekulare Neurogenetik befasst sich mit der Stammzellbiologie und Krebserkrankungen des zentralen Nervensystems. Unser vorrangiges Ziel ist es, die grundlegenden Mechanismen der Plastizität von Hirntumoren zu entschlüsseln und innovative Therapien zu entwickeln, die die Behandlung von Glioblastomen verbessern.
Bild: Organoid @ DKFZ,
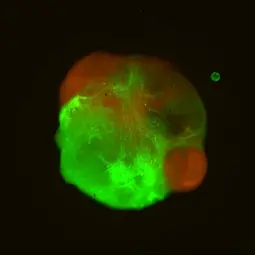
Bild: Organoid @ DKFZ,
Unsere Forschung
In der Abteilung für Molekulare Neurogenetik konzentriert sich unsere Forschung auf die Aufklärung der molekularen Mechanismen, die die Gehirnentwicklung und -pathologie steuern, mit einem besonderen Fokus auf Gehirntumoren. In den letzten Jahren haben wir wichtige Regulatoren von Gehirntumorstammzellen identifiziert, darunter TLX und GPD1. Besonders hervorzuheben ist, dass unsere Arbeit gezeigt hat, dass das Ausschalten dieser Faktoren in vivo einen Überlebensvorteil bietet (Cell Stem Cell, 2014). Diese Entdeckung wurde als eine der besten Arbeiten des Jahres anerkannt und in Nature Reviews Cancer hervorgehoben.
In jüngerer Zeit haben wir GPD1 als den ersten bekannten Marker und essenziellen Regulator für ruhende Gehirntumorstammzellen identifiziert (Cell Stem Cell, 2019). Dies liefert entscheidende Einblicke in ein aufkommendes Forschungsgebiet zur Tumordormanz in verschiedenen Tumortypen. Darüber hinaus haben unsere Studien die zentrale Rolle des CHARGE-Syndrom-Proteins CHD7 bei der Steuerung der Zelldifferenzierung aufgezeigt – eine Entdeckung, die ein fundamentales Verständnis des CHARGE-Syndroms ermöglicht (Cell Stem Cell, 2013; Nature Communications, 2017).
Zukunftsperspektive:
Derzeit arbeiten wir an der Entwicklung hochentwickelter menschlicher Gehirn-Organoid- und Gehirntumor-Organoid-Modelle, die die genetischen und phänotypischen Merkmale von Gehirntumoren genau nachbilden (NPJ Precis Oncol. 2024, Cell Stem Cell, 2025). Durch den Einsatz modernster Einzelzell-Technologien, CRISPR/Cas9-Genomeditierung und künstlicher Intelligenz möchten wir die molekulare und zelluläre Heterogenität im menschlichen Glioblastom untersuchen, mit einem besonderen Schwerpunkt auf ruhende Krebsstammzellen. Unser langfristiges Ziel besteht darin, unsere grundlegenden Erkenntnisse in klinische Anwendungen zu übertragen, um effektive Behandlungen für Glioblastome zu entwickeln, eine der tödlichsten Krebserkrankungen beim Menschen.
Projekte
- Krebsstammzellen gezielt unschädlich machen
- Modellierung menschlicher Tumoren mit Hilfe von LEGO Organoiden
- Prädiktive, vom Patienten abgeleitete Modelle für die personalisierte Neuroonkologie
- Molekulare Prinzipien in neuralen Stammzellen, Neurogenese und Krankheiten des Zentralen Nervensystems
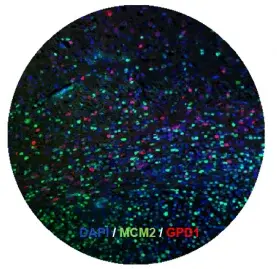
Unsere früheren Entdeckungen haben gezeigt, dass Krebsstammzellen das richtige Ziel für die Behandlung des Glioblastoms sind (2014, Cell Stem Cell). Wir haben kürzlich die ersten ruhenden Hirntumor-Stammzellen (2019, Cell Stem Cell) identifiziert, die gegen herkömmliche Therapien resistent sind und in diesem Zusammenhang konnten wir entscheidende Regulatoren der Ruhephase von Krebsstammzellen ausfindig machen. Derzeit entwickeln wir mehrere Substanzen, die darauf abzielen, Hirntumorstammzellen zu eliminieren. Diese sollen künftig in klinischen Studien weiter getestet werden. In diesem Projekt sind wir besonders daran interessiert die Signalwege der Zelle anzusteuern, die den Stoffwechsel von Tumorzellen regulieren.
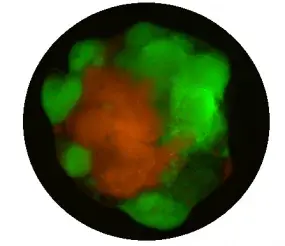
Um das genetische Spektrum des menschlichen Glioblastoms (GBM) systematisch zu modellieren, verwenden wir aus menschlichen induzierten pluripotenten Stammzellen (iPSC) gewonnene Organoide, um die genetische Heterogenität innerhalb des GBM aufzuklären. Mithilfe von CRISPR/Cas9 erzeugten wir in menschlichen iPSCs ein umfassendes Spektrum an Mutationskombinationen (Pten, Trp53, Cdkn2a, Cdkn2b, Nf1, Rb1, Egfr, Tert, etc.), die die am häufigsten mutierten Gene in menschlichem GBM sind. Anschließend haben wir aus diesen Zellen GBM-Organoide gezüchtet, die wir als LEGO bezeichnen: Laboratory Engineered Glioma Organoid (npj Preci Onco, 2024). Diese Organoide bilden die wichtigsten molekularen Merkmale des menschlichen GBM wirksam nach.
Im LEGO2.0-Modell haben wir die Originaltreue weiter verbessert, indem wir Strichcodes, Immunzellen und Blutgefäße integriert haben. Dieses umfassende Modell ermöglicht es uns, die Wechselwirkung zwischen genetischer Heterogenität und funktioneller Heterogenität im GBM systematisch zu untersuchen. Darüber hinaus wird derzeit ein Medikamentenscreening durchgeführt, um eine genotypbasierte Medikamentenreferenz für die personalisierte Behandlung von GBM zu erstellen.
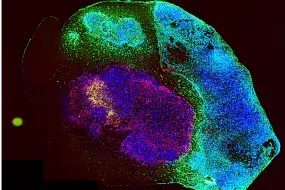
Tumororganoide sind ein zentrales Instrument in der Krebsforschung, doch die derzeitigen Modelle stoßen auf Grenzen, die ihre Anwendung bei der Vorhersage von therapeutischen Reaktionen behindern. Um diese Herausforderung zu meistern, haben wir ein hochentwickeltes Kultursystem (IPTO, individualized patient tumor organoid, Cell Stem Cell, 2025) entwickelt, das die zelluläre und molekulare Pathologie menschlicher Hirntumore genau simuliert. Von Patienten stammende Tumorexplantate wurden in aus induzierten pluripotenten Stammzellen (iPSC) abgeleiteten zerebralen Organoiden kultiviert, was die Kultivierung eines breiten Spektrums menschlicher Tumoren im zentralen Nervensystem (ZNS) ermöglicht, einschließlich erwachsener, pädiatrischer und metastasierender Hirntumoren. Histopathologische, genomische, epigenomische und Einzelzell-RNA-Sequenzierungsanalysen (scRNA-seq) ergaben, dass das IPTO-Modell die zelluläre Heterogenität und die molekularen Merkmale der ursprünglichen Tumoren genau rekapituliert.
Insbesondere konnten wir zeigen, dass das IPTO-Modell in einer prospektiven Patientenkohorte das patientenindividuelle Ansprechen auf Medikamente, einschließlich Resistenzmechanismen, genau vorhersagt. Insgesamt stellt das IPTO-Modell einen bedeutenden Fortschritt bei der präklinischen Modellierung menschlicher Krebserkrankungen dar und ebnet den Weg für eine personalisierte Krebstherapie. Das IPTO-Modell wird auch für die Entdeckung und Validierung von Zielmolekülen sowie für T-Zell-basierte Krebstherapien eingesetzt. Die aus den IPTO-Modellen gewonnenen hochwertigen Daten zum Ansprechen auf Medikamente werden zum Trainieren von prädiktiven generativen KI-Modellen für die Vorhersage des Ansprechens von Patienten verwendet.

Wir haben eine Reihe von Mausmodellen und menschlichen Organoidmodellen generiert, die es uns ermöglichen, die Genexpression in neuralen Stammzellen (NSC) und Hirntumor-Stammzellen präzise zu manipulieren. In diesem Projekt widmen wir uns der Frage, auf welche Weise die dynamische Transkriptionsregulierung an der Konfiguration der Zell -identität, -aktivität und des Schicksals von NSCs beteiligt ist. Wir analysieren systematisch die Rolle essentieller Transkriptionsfaktoren und Chromatinregulatoren in der Neurogenese, um die molekularen Prinzipien der Zellidentitätsbestimmung zu eruieren. Insbesondere interessieren wir uns für die Untersuchung von Transkriptionsregulatoren wie Nr2e1 und Chd7, die bei menschlichen neurologischen Erkrankungen und Hirntumoren mutiert sind.
Ressourcen
Unser Team
- Profil anzeigen

Dr. Haikun Liu
Abteilungsleiter
-

Heike Alter
Technische Angestellte
-

Yuling Chen
Doktorandin
-

Jin Chen
Doktorandin
-

Claudia Guevara Lanero
Master Studentin
-

Yassin Harim
Doktorand
-

Yixuan Hu
-
Sophia Kornherr
Master Studentin
-

Xian Li
Doktorandin
-

Xiaoyu Ma
Doktorandin
-

Gabriele Meyer
Fremdsprachensekretärin
-

Chrysafenia Papavissarion
Master Studentin
-

Yiwei Qi
Besuchender PostDoc
-

Miguel Sanchez Oliveros
Besuchender Master Student
-

Nadja Stöffler
Technische Angestellte
-

Dr. Weili Tian
PostDoc
-

Cara Sophie Timmerhoff
Master Studentin
-

Angela Valentino
Besuchende Doktorandin
-
Beatrice Valerie Wagner
-

Qing Zheng
Visiting PhD Student
-

Yue Zhuo
Doktorand
Ausgewählte Publikationen
Peng T, Ma X, Hua W, Wang C, Chu Y, Sun M, Fermi V, Hamelmann S, Lindner K, Shao C, Zaman J, Tian W, Zhuo Y, Harim Y, Stöffler N, Hammann L, Xiao Q, Jin X, Warta R, Lotsch C, Zhuang X, Feng Y, Fu M, Zhang X, Zhang J, Xu H, Qiu F, Xie L, Zhang Y, Zhu W, Du Z, Salgueiro L, Schneider M, Eichhorn F, Lefevre A, Pusch S, Grinevich V, Ratliff M, Loges S, Bunse L, Sahm F, Xiang Y, Unterberg A, von Deimling A, Platten M, Herold-Mende C, Wu Y, Liu HK*, Mao Y. (* Hauptansprechpartner)
Wang C, Sun M, Shao C, Schlicker L, Zhuo Y, Harim Y, Peng T, Tian W, Stöffler N, Schneider M, Helm D, Chu Y, Fu B, Jin X, Mallm JP, Mall M, Wu Y, Schulze A, Liu HK.
Venkataramani V, Tanev DI, Strahle C, Studier-Fischer A, Fankhauser L, Kessler T, Körber C, Kardorff M, Ratliff M, Xie R, Horstmann H, Messer M, Paik SP, Knabbe J, Sahm F, Kurz FT, Acikgöz AA, Herrmannsdörfer F, Agarwal A, Bergles DE, Chalmers A, Miletic H, Turcan S, Mawrin C, Hänggi D, Liu HK, Wick W, Winkler F, Kuner T.
Rusu P, Shao C, Neuerburg A, Acikgöz AA, Wu Y, Zou P, Phapale P, Shankar TS, Döring K, Dettling S, Körkel-Qu H, Bekki G, Costa B, Guo T, Friesen O, Schlotter M, Heikenwalder M, Tschaharganeh DF, Bukau B, Kramer G, Angel P, Herold-Mende C, Radlwimmer B, Liu HK.
Alle Publikationen
Ausgewählte Auszeichnungen und Preise
- ERC (European Research Council) Consolidator Award für Hai-Kun. DKFZ Pressemitteilung
- Hai-Kun erhält den Chica und Heinz Schaller Förderpreis 2015 von der C.H.S.- Stiftung (Chica und Heinz Schaller -Stiftung). DKFZ Pressemitteilung
- Hai-Kun bekommt den ersten DKFZ Alumnipreis für internationale Wissenschaftler.
- Hai-Kun wurde als Teilnehmer des EMBO Young Investigator Programms 2014 ausgewählt.
- ISSCR travel award für Zhe
- Bestes Photo beim Bilder Wettbewerb der DKFZ Doktoranden für Gözde
- ISSCR travel award für Weijun
- Helmholtz-Nachwuchsförderpreis für Hai-Kun, Förderpreis des Labors
Förderung

Events
Kontaktieren Sie uns









