NMR-Spektroskopie und CEST-Bildgebung
Den Krebs-Stoffwechsel in Vivo aufdecken
Unsere Forschungsgruppe entwickelt nicht-invasive metabolische und molekulare MR-Techniken unter Verwendung von 1H- und X-Kernen, einschließlich hochauflösender NMR-Spektroskopie (MRS) und MR-spektroskopischer Bildgebung (MRSI) bei ultrahohen Feldern (B0 ≥ 7T), MR-Bildgebung mit chemischem Austausch-Sättigungstransfer (CEST) und hyperpolarisiertem Kohlenstoff-13 (HYP 13C). Ein besonderer klinischer Forschungsschwerpunkt ist die molekulare Gewebecharakterisierung von Hirntumoren zur Stratifizierung genetischer Subtypen und zur Beurteilung des Ansprechens auf Therapien. Ein weiterer Schwerpunkt ist die Entwicklung neuartiger Bildgebungsverfahren zur besseren molekularen Charakterisierung von Brustkrebs.
Forschungsthemen
- Abbildung physiologischer Parameter, insbesondere des pH-Werts
- Bewertung des Energiestoffwechsels von Geweben
- Bewertung von Veränderungen im Proteom des Gewebes
- Identifizierung von Bildgebungssurrogaten für klinische Biomarker unter Verwendung von Metabolitsignalen und molekularen Kontrastmechanismen
- Entwicklung neuer molekularer Bildgebungsverfahren
- Klinische Umsetzung der entwickelten Bildgebungsverfahren
Außerdem ist unsere Forschungsgruppe an den folgenden Konsortialprojekten beteiligt:
MIRACLE, die Plattform für virtuelle Biopsien; Einführung von Metabolic MRI-as-a-Service für die onkologische Versorgung (HORIZON-EIC-finanziertes Projekt)
HYPERBOLIC - Visualisierung von Krebsmerkmalen durch maßgeschneiderte hyperpolarisierte Magnetresonanztomographie (vom DKTK finanziertes Projekt)

Die NMR-Spektroskopie (MRS) ermöglicht den Nachweis von Signalen von Atomkernen mit Spin I≠0, die an Biomoleküle gebunden sind. Die biochemischen Informationen werden nicht-invasiv und ohne ionisierende Strahlung gewonnen.
Mehrere Spin-Spezies liefern in vivo NMR-Spektren mit einer Aufnahmezeit von wenigen Minuten, z. B. Spin-½-Kerne wie 1H (Informationen über Hirnstoffwechselprodukte) und 31P (Informationen über Energiestoffwechsel, Membranphospholipidumsatz und intrazellulären pH-Wert). Die Kombination von MRS mit MR-Bildgebungstechniken (MRI) wird als MR-spektroskopische Bildgebung (MRSI) bezeichnet, die Karten der regionalen Häufigkeit und Verteilung von Metaboliten im Gewebe liefert.
Die Einführung von Ultrahochfeld-MR-Scannern (Magnetfeldstärke B0 ≥ 7 Tesla) eröffnete neue Perspektiven für die MRS und die MRSI, da sie eine höhere Empfindlichkeit und spektrale Auflösung aufweisen und somit mehr Metaboliten nachweisen können. Um die klinische Anwendbarkeit der MRSI zu fördern, konzentriert sich unsere Forschungsgruppe auf die Entwicklung von hochauflösenden MRSI-Methoden bei UHF, um einige technische Herausforderungen zu überwinden, die bei höheren Feldern auftreten.
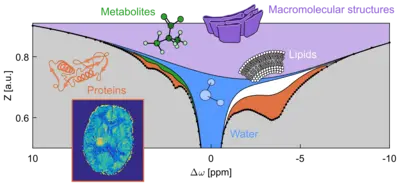
Metaboliten mit geringer Molekülmasse (z. B. Kreatin und Glukose), Proteine und andere makromolekulare Strukturen tragen an ihrer Oberfläche schwach gebundene Protonen (1H-Kerne), die mit Protonen in benachbarten Wassermolekülen austauschen können. Dieser Prozess, der als chemischer Austausch (CE) bezeichnet wird, findet spontan statt und hängt von der Konzentration, dem pH-Wert, der Temperatur und anderen Eigenschaften der Lösung ab.
Austauschende Protonen können im 1H-NMR-Spektrum bei unterschiedlichen Frequenzen („chemische Verschiebungen“) mitschwingen. Daher können sie selektiv markiert werden (z. B. durch resonante Hochfrequenzbestrahlung), um eine gleichmäßige Verteilung der beiden 1H-Spinzustände in einem Magnetfeld zu erreichen - diese Technik wird als Sättigung bezeichnet. Durch chemischen Austausch wird diese Information in den Wasserpool gepumpt. Die fortlaufende Bestrahlung akkumuliert die Sättigung im Wasserpool und erzeugt den CEST-Effekt (chemical exchange saturation transfer), d. h. eine nachweisbare Verringerung des NMR-Signals der Wasserprotonen. Der Verstärkungseffekt kann mehrere Größenordnungen ausmachen. Im Gegensatz zur konventionellen NMR-Spektroskopie (MRS), die das Signal fest gebundener, also unveränderlicher Kerne (1H, 13C, 19F, 31P...) erfasst, nutzt CEST das Wassersignal, um indirekt das Signal schwach gebundener Protonen in Biomolekülen zu erfassen.
Wenn CEST mit MR-Bildgebungsverfahren (MRI) kombiniert wird, können verschiedene Einheiten zellulärer Verbindungen - wie in der Abbildung dargestellt - in lebendem Gewebe (in vivo) mit einer mit der herkömmlichen MRT vergleichbaren Empfindlichkeit gescannt werden. Seit der Entdeckung des Phänomens im Jahr 2000 wurde die CEST-MRI für die diagnostische Bildgebung bei verschiedenen Krankheiten (z. B. Tumoren, Schlaganfall, neurodegenerative Erkrankungen) eingesetzt. Diese Studien ergaben neue Informationen über diese Krankheiten auf molekularer Ebene.
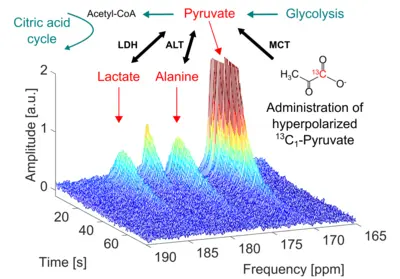
Das NMR-Signal in lebendem Gewebe ist im Wesentlichen durch die verfügbare thermische Polarisation von P ≈ 10-6 begrenzt. Außerhalb von Geweben können die Polarisationswerte jedoch mit Hilfe von Hyperpolarisationstechniken, z. B. der dynamischen Kernpolarisation (DNP), auf Werte von P ≈ 0,5 manipuliert werden, was zu einer enormen Verstärkung des NMR-Signals um etwa fünf Größenordnungen führt. Nach der Verabreichung von Substanzen, die hyperpolarisierte Spins tragen, kann das höchste NMR-Signal auch in lebendem Gewebe für die Lebensdauer der polarisierten Zustände (in der Größenordnung von Minuten) ausgewertet werden, was NMR-Anwendungen von bisher unerreichter Empfindlichkeit ermöglicht.
Eine solche Anwendung ist die metabolische MR unter Verwendung von hyperpolarisiertem 13C (siehe Abbildung): 13C-angereicherte, endogene Substrate (z. B. 1-13C-Pyruvat) werden hyperpolarisiert und anschließend in Lebewesen verabreicht, wo der zelluläre Stoffwechsel die hyperpolarisierten 13C-Kerne auf andere Substanzen „überträgt“. Infolgedessen werden auch die NMR-Signale nachgeschalteter Stoffwechselprodukte (z. B. 1-13C-Lactat) verstärkt und nachweisbar. Mit Hilfe dynamischer 13C-NMR-Techniken kann jeder hyperpolarisierte Metabolit anhand seiner individuellen 13C-Resonanzfrequenz (chemische Verschiebung) identifiziert werden, und die Verfolgung des zeitlichen Verlaufs der hyperpolarisierten Signale ermöglicht die Quantifizierung der enzymatischen Aktivität (z. B. der Lactat-Dehydrogenase) in Echtzeit.
Auf diese Weise können die Stoffwechselveränderungen von Krebsgeweben bewertet werden, z. B. die erhöhte Aktivität der Laktat-Dehydrogenase, die zu einem erhöhten Fluss von Pyruvat zu Laktat im Vergleich zu gesundem Gewebe führt. Um die Bewertung des Krebsstoffwechsels mittels hyperpolarisiertem 13C auch beim Menschen zu ermöglichen, etabliert unsere Forschungsgruppe derzeit diese Spitzentechnologie mit einem SPINlabTM DNP-System für die klinische Anwendung.
Publikationen der Gruppe
Kontakt
-

Dr. Andreas Korzowski
Arbeitsgruppenleiter
-

Dr. Philip Boyd
Projektgruppenleiter
-

Dr. Vanessa Franke
Projektgruppenleiterin