Translationale Gastrointestinale Onkologie und Präklinische Modelle
- DKFZ-Hector Krebsinstitut
- Funktionelle und Strukturelle Genomforschung
- Klinische Kooperationseinheit
- Nachwuchsgruppe

apl. Prof. Dr. Johannes Betge
Group Leader
Die Heilung von fortgeschrittenen Krebserkrankungen des Verdauungstrakts ist eine große Herausforderung. Wir tragen zur Verbesserung der Behandlung dieser Erkrankungen bei, indem wir Erkenntnisse zur Tumorbiologie und Therapieresistenz mithilfe modernster Hochdurchsatzverfahren in patientenabgeleiteten Tumormodellen gewinnen und diese Erkenntnisse durch innovative klinische Studien in die Klink bringen.
Bild: Patient derived organoids from a colorectal cancer patient, DNA (magenta), actin cytoskeleton (cyan), dead cells (yellow). | © dkfz.de,
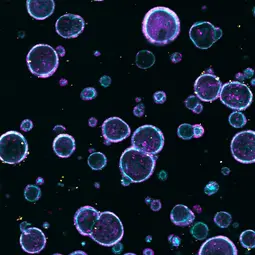
Bild: Patient derived organoids from a colorectal cancer patient, DNA (magenta), actin cytoskeleton (cyan), dead cells (yellow). | © dkfz.de,
Unsere Forschung
Tumoren des Verdauungstrakts gehören weltweit zu den häufigsten Krebserkrankungen. Trotz bedeutender Fortschritte in der Krebstherapie bleibt die Heilung für viele Patientinnen und Patienten mit metastasierten Tumoren nach wie vor eine Herausforderung. Das übergeordnete Ziel unserer Arbeitsgruppe ist daher, neue, individualisierte Therapien für Patient*innen mit gastrointestinalen Tumoren zu entwickeln, sowie neue prädiktive Faktoren zu etablieren, die das Ansprechen auf Krebstherapien besser vorhersagen können.
Schwerpunkte
Unser Fokus liegt auf der Untersuchung der Tumorbiologie bei gastrointestinalen Tumoren - insbesondere auf den Mechanismen, die zur Resistenz gegenüber Krebstherapien führen - und der Translation dieser Erkenntnisse in die klinische Praxis. Wir konzentrieren uns dabei insbesondere auf:
- Die Identifizierung und Charakterisierung von Genen und Signalwegen, die das Ansprechen und die Resistenz gegenüber Chemotherapien und zielgerichteten Therapien beeinflussen
- Mechanismen der Anpassung von Tumorzellen an Behandlungen
- Die Testung neuer Therapien und Kombinationsansätze (z. B. Medikamente, Strahlentherapie) in präklinischen Studien und die Analyse der zugrunde liegenden Mechanismen.
Methoden und Technologien
Um die komplexen Mechanismen von Tumorbiologie und Therapieresistenz von Tumoren zu verstehen, setzen wir modernste Technologien ein:
- Organoid-Modelle: Wir nutzen 3D-Zellkulturen, die direkt aus Tumor- und Normalgewebe unserer Patientinnen und Patienten gewonnen werden. Diese Organoide bewahren wesentliche molekulare Eigenschaften der Tumoren und dienen als präzise Modelle zur Analyse von Therapien.
- Hochdurchsatz-Wirkstofftests: Mit unseren robotergestützten Plattformen testen wir zeitgleich hunderte Medikamente auf ihre Wirksamkeit in Organoiden.
- Multi-Omics Ansätze: Durch den Einsatz von genomischen, transkriptomischen und proteomischen Daten entschlüsseln wir Zusammenhänge zwischen molekularen Veränderungen und Therapieansprechen.
- Einzelzelltechnologien: Hochdurchsatz-Mikroskopie und Einzelzell-Sequenzierung, auch in Kombination mit Co-Kulturen des Tumormikromilieus, ermöglichen uns detaillierte Einblicke in Zell-Zell-Interaktionen.
Eindrücke
-

Colon Cancer Organoids, brightfield. © dkfz.de -

High-Throughput Pipetting 384-wells, © dkfz.de -

Extracellular Matrix Domes in a 6-Well Plate, © dkfz.de -
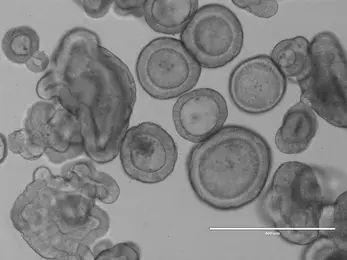
Colon Cancer Organoids, brightfield. © dkfz.de -

Immunofluorescence stainings of colorectal cancer organoids. Blue = DAPI, red = phalloidin, green = alpha tubulin.© dkfz.de
Ziele und gesellschaftliche Relevanz
Unser Ziel ist es, ein tieferes Verständnis der Mechanismen von Therapieansprechen in gastrointestinalen Karzinomen zu gewinnen und die Erkenntnisse aus unseren präklinischen Projekten als Grundlage für die Entwicklung und Umsetzung klinischer Studien zu nutzen, um sicherzustellen, dass unsere Forschung den Patientinnen und Patienten zugutekommt. Mit einem personalisierten Ansatz zur Nutzung von Organoid-basierten Tests wollen wir zudem individuelle Therapieoptionen für Patient*innen mit fortgeschrittenen gastrointestinalen Tumoren identifizieren.
Wir arbeiten eng mit klinischen und wissenschaftlichen Partnerinnen und Partnern in Heidelberg, Mannheim, national und international zusammen, um unsere Forschungsergebnisse in die Klinik zu bringen und langfristig die Behandlungsmöglichkeiten für Krebspatientinnen und Patienten zu verbessern.

Team
-

apl. Prof. Dr. Johannes Betge
Group Leader
-

Dr. Theresa Mulholland
Postdoc
-
Yvonne Petersen
Lab Technician
-

Philipp Albrecht
PhD Student
-

Ekin Karabati
MD Student
-

Lucrezia Tondo
PhD Student
-

Dr. Kyrhatii Trikhirhisthit
Clinician Scientist
-

Zhenchong Li
MD Student
-

Qiaoling Zhang
MD Student
-

Ping Sui
MD Student
-

Julian Emanuel Riedesser
MD Student
-
Shrihar Kanikar
Technician (Mannheim)
Ausgewählte Publikationen
From organoids to bedside: Advances in modeling, decoding and targeting of colorectal cancer
Betge J, Jackstadt R.
The drug-induced phenotypic landscape of colorectal cancer organoids
Betge J, Rindtorff N, Sauer J, Rauscher B, Dingert C, Gaitantzi H, Herweck F, Srour-Mhanna K, Miersch T, Valentini E, Boonekamp KE, Hauber V, Gutting T, Frank L, Belle S, Gaiser T, Buchholz I, Jesenofsky R, Härtel N, Zhan T, Fischer B, Breitkopf-Heinlein K, Burgermeister E, Ebert MP, Boutros M.
Precision Medicine for Metastatic Colorectal Cancer in Clinical Practice
Riedesser J, Ebert MP, Betge J.
Cancer-Associated Mutations in Normal Colorectal Mucosa Adjacent to Sporadic Neoplasia
Zhan T, Belle S, Valentini E, Herrmann S, Miersch T, Li M, Gaiser T, Boutros M, Ebert MP, Betge J.
Loss of Chromosome 18q11.2-q12.1 Is Predictive for Survival in Patients With Metastatic Colorectal Cancer Treated With Bevacizumab
van Dijk E, Biesma HD, Cordes M, Smeets D, Neerincx M, Das S, Eijk PP, Murphy VS, Barat A, Bacon O, Prehn JHM, Betge J, Gaiser T, Fender B, Meijer GA, McNamara DA, Klinger R, Koopman M, Ebert MPA , Kay EW, Hennessey BT, Verheul HMW, Gallagher WM, O'Connor DP, Punt CJA, Loupakis F, Lambrechts D, Byrne AT, van Grieken NCT, Ylstra B.
Preprints
Qiyun Xiao, JulianE. Riedesser, Theresa Mulholland, Zhenchong Li, Jonas Buchloh, Philipp Albrecht, Moying Li, Nachiyappan Venkatachalam, Olga Skabkina, Anna Klupsch, Ella Eichhorn, LiWang, Sebastian Belle, Nadine Schulte, Daniel Schmitz, Matthias F. Froelich, Erica Valentini, Kim E. Boonekamp, Yvonne Petersen, Thilo Miersch, Elke Burgermeister, Carsten Herskind, Marlon R. Veldwijk, Christoph Brochhausen, Robert Ihnatko, Jeroen Krijgsveld, Ina Kurth, Michael Boutros, Matthias P. Ebert, Tianzuo Zhan, Johannes Betge
Kontaktieren Sie uns

