Phänotypische Plastizität

Dr. Bernhard Radlwimmer
Phänotypische Plastizität beschreibt die Fähigkeit von Krebszellen, ihren Phänotyp schnell an äußere Signale anzupassen. Sie ist die Hauptursache für Therapieresistenz in vielen Krebsarten.

Unsere Forschung
Das Glioblastom ist der aggressivste und tödlichste primäre Hirntumor bei Erwachsenen. Es zeichnet sich durch eine bemerkenswerte intra-tumorale Heterogenität und Plastizität auf molekularer und zellulärer Ebene aus. Diese Eigenschaften ermöglichen es dem Tumor, sich schnell der Therapie zu entziehen, was fast zwangsläufig zu einem Rückfall und zur Entwicklung einer therapieresistenten Tumorform führt.
Wir gehen dieses Problem aus verschiedenen Perspektiven an, indem wir zellbiologische Methoden, Einzelzell-Sequenzierung und KI-gestützte Ansätze nutzen, um epigenetische Mechanismen der Zellzustandsplastizität in patientenabgeleiteten Tumormodellen und iPSC-basierten Organoidsystemen zu untersuchen.
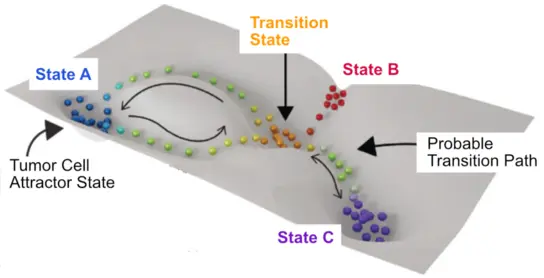
Kartierung von Plastizitätslandschaften
Um Therapieansprechen vorherzusagen und personalisierte Behandlungsansätze zu identifizieren, kartieren wir die Plastizitätslandschaft des Glioblastoms. Gemeinsam mit unseren Partnern des AI-Care-Konsortiums verwenden wir Multi-Omics-Analysen patientenabgeleiteter und gentechnisch veränderter Glioblastom-Organoide sowie KI-gestützte Modellierungen, um die molekularen Mechanismen der Zellzustandsplastizität und der Therapievermeidung zu identifizieren. Dieses Projekt ist Teil der Initiative AI-in-Health, die von der Carl-Zeiss-Stiftung gefördert wird.
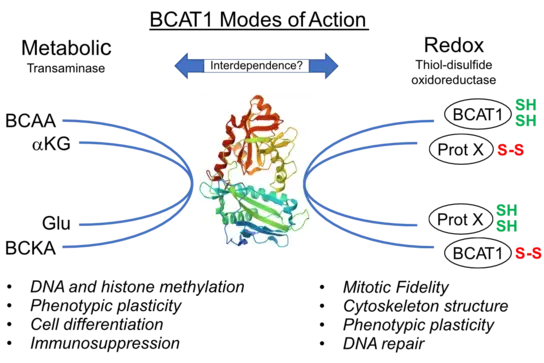
Epigenetische und Redox-Signalwege in der Zellzustandsplastizität
In einem Bottom-up-Ansatz charakterisieren wir die Rolle der Branched-Chain-Amino-Acid-Transaminase 1 (BCAT1) in der Zellzustandsplastizität. Unsere jüngsten Untersuchungen zeigen, dass BCAT1 ein sogenanntes "Moonlighting-Protein" ist, das sowohl metabolische als auch epigenetische und redoxregulatorische Funktionen besitzt. Es hat Einfluss auf unter anderem die Zellteilung, die Zelldifferenzierung und die Immunsuppression.
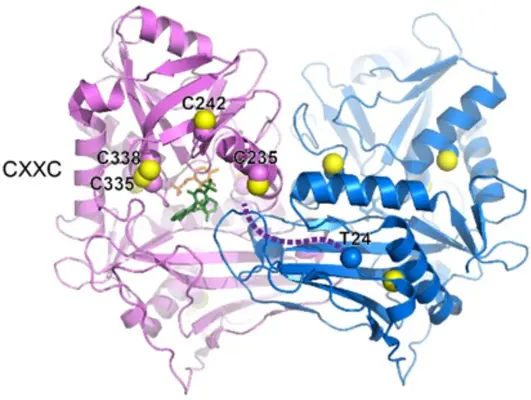
BCAT1-Redox-Mechanismus und Inhibition
Um die Wirkungsweise von BCAT1 besser zu verstehen, analysieren wir dessen Redox-Mechanismus mit biochemischen und genetischen Methoden. Basierend auf diesen neuen mechanistischen Bezugsrahmen entwickeln wir gemeinsam mit unseren Partnern nicht-kovalente und kovalente Inhibitoren.
Ausgewählte Publikationen
Man KH, Wu Y, Gao Z, Spreng AS, …, Liu HK, Imbusch CD, Lichter P, Radlwimmer B.
Boskovic P, Wilke N, Man KH, Lichter P, Francois L, Radlwimmer B.
Francois L, Boskovic P, Knerr J, He W, Sigismondo G, …, Krijgsveld J, Hiller K, Grosse R, Lichter P, Radlwimmer B.
Wu Y, Fletcher M, Gu Z, ..., Herrmann C, Radlwimmer B.
Tönjes M, Barbus S, Park YJ, Wang W, …, Reifenberger G, Lichter P, Radlwimmer B.
Kontaktieren Sie uns
