Pathogenese infektionsbedingter Tumoren
- Immunologie, Infektion und Krebs

Prof. Dr. Henri-Jacques Delecluse
Group Leader
Das Epstein-Barr-Virus (EBV) infiziert die große Mehrheit der Bevölkerung und ist für 1 bis 2 % aller Krebserkrankungen verantwortlich. Unsere Projekte zielen darauf ab zu verstehen, wie das Virus diese Tumore auslöst.
Unsere Forschung
Das Epstein-Barr-Virus (EBV) infiziert die große Mehrheit der Bevölkerung und ist für 1 bis 2 % aller Krebserkrankungen verantwortlich. EBV ist auch für die Entwicklung der infektiösen Mononukleose (IM, auch Pfeiffersche Drüsenfieber genannt), einem häufigen und potenziell schwächenden infektiösen Syndrom, verantwortlich. Jüngste epidemiologische Studien haben gezeigt, dass EBV eine wichtige Rolle bei der Entstehung von Autoimmunkrankheiten spielt, insbesondere bei der Multiplen Sklerose. Schließlich ist es eines der letzten Tumorviren, für das es weder einen präventiven Impfstoff noch eine heilende Behandlung gibt.
Unsere Projekte zielen darauf ab, zu verstehen, wie das Virus diese Tumore auslöst. Wir haben bereits herausgefunden, dass die zahlreichen vom Virus kodierten microRNAs seine onkogenen Eigenschaften modulieren (Lin et al., PLoS Path 2015; Bernhardt et al., PLoS Path 2016; Haar et al., NAR 2016). Anschließend richteten wir unsere Aufmerksamkeit auf die Rolle von Virusvarianten bei der Entstehung von Krebserkrankungen (Li et al., Nature Microbiology 2019; Tsai et al., Cell reports 2015). In der Tat weisen einige EBV-assoziierte Tumoren wie Nasopharynxkarzinome und Burkitt-Lymphome eine auffallend heterogene geografische Verteilung auf. Wir haben gezeigt, dass einige dieser Unterschiede durch die Infektion mit bestimmten Typen von Epstein-Barr-Viren erklärt werden können.
Eine weitere interessante Frage ist der Beitrag der lytischen Replikation, des Prozesses, der zur Produktion von Viren führt, zur Krebsentwicklung. Wir haben gezeigt, dass die infektiösen EBV-Partikel die Zentrosomenmaschinerie deregulieren und genetische Instabilität induzieren können (Shumilov et al., Nature Comm 2017). Dieses neu identifizierte Krebsrisiko ist unabhängig vom viralen Genom und könnte das Spektrum der durch das Virus verursachten Krankheiten erheblich erweitern.
In jüngster Zeit haben wir ein gemeinsames Projekt begonnen, um die Rolle des EBV bei der Entwicklung der Autoimmunerkrankung Multiple Sklerose zu untersuchen. Wir werden die Wechselwirkungen zwischen dem Virus und dem Wirt untersuchen, wobei wir uns auf die Rolle von Polymorphismen, sowohl viraler als auch zellulärer Art, konzentrieren und darauf, wie sie die Immunantwort gegen das Virus beeinflussen.
Wir haben auch eine neue Art der Immuntherapie entwickelt, die auf Antikörpern basiert, die Oberflächenproteine auf Tumorzellen erkennen und mit viralen Antigenen kombiniert werden. Der Antikörperanteil bindet sich an die Tumorzellen und ermöglicht die Internalisierung der viralen Antigene. Diese wiederum werden auf MHC-Klasse-II-Moleküle geladen und ermöglichen die Erkennung der Tumorzellen durch T-Zellen, die spezifisch für das virale Antigen sind. Diese mit Antigenen beladenen Antikörper (AgAbs) haben ihre Wirksamkeit in einem Lymphom-Modell in vitro bewiesen. Seitdem haben wir Hinweise für die Wirksamkeit und Sicherheit in einem Tiermodell für akute myeloische Leukämie erhalten.
ZUKÜNFTIGE AUSSICHTEN
Wir werden unsere Projekte zu den molekularen Mechanismen von EBV-induziertem Krebs fortsetzen und ein neues Projekt zur Rolle von EBV bei der Entstehung von Multipler Sklerose und anderen Autoimmunkrankheiten entwickeln. Ein weiterer Schwerpunkt wird die Weiterentwicklung von immuntherapeutischen Strategien auf der Grundlage von antigenbeladenen Antikörpern sein.
Projekte
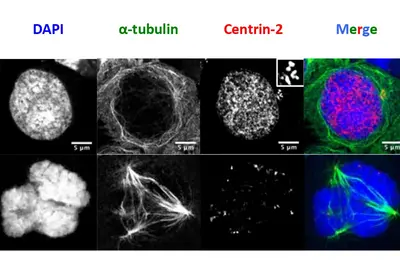
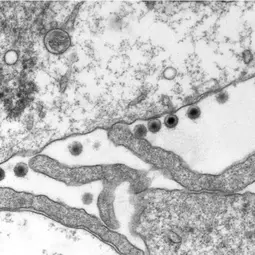
Infektionen mit dem Epstein-Barr-Virus (EBV) werden mit der Entstehung von Krebs in Verbindung gebracht. Die lytische Replikation des EBV, der Prozess, der Virusnachkommen erzeugt, ist ein starker Risikofaktor für einige Krebsarten. Wir haben kürzlich berichtet, dass eine EBV-Infektion von B-Lymphozyten in vitro und in einem Mausmodell zu einer erhöhten Rate an Zentrosomenamplifikation führt (Abbildung 1), die mit chromosomaler Instabilität einhergeht. Wichtig ist, dass dieser Effekt mit virusähnlichen Partikeln ohne EBV-DNA reproduziert werden kann, nicht aber mit defekten virusähnlichen Partikeln, die keine Wirtszellen infizieren können, weil ihnen ein Glykoprotein fehlt, das am Eintritt in die Zielzellen beteiligt ist.
Wir konnten erstmals das virale Tegumentprotein BNRF1 als Auslöser der Zentrosomen-Amplifikation durch Überduplikation der Zentrosomen-Maschinerie identifizieren. EBV-Mutanten, denen BNRF1 fehlt, haben diese Eigenschaft verloren, aber sie kann durch Wiedereinführung des BNRF1-Proteins in das Viruspartikel wiederhergestellt werden. Wichtig ist, dass BNRF1 in transfizierten Zellen im Zentrosom-Kompartiment lokalisiert ist. Damit wurde ein neuer Mechanismus identifiziert, durch den EBV-Partikel eine chromosomale Instabilität hervorrufen können, ohne eine chronische Infektion zu verursachen, wodurch ein Risiko für die Entwicklung von Tumoren entsteht, die nicht unbedingt das virale Genom tragen.
In laufenden Projekten wird untersucht, welchen Beitrag andere EBV-Proteine zur Entwicklung genetischer Instabilität beitragen und wie sie mit der Zellmaschinerie interagieren, um diese Anomalien zu verursachen.
Multiple Sklerose (MS) ist eine neurologische Erkrankung, bei der das Immunsystem die Myelinschicht im Gehirn und Rückenmark irreversibel schädigt, was zu schwerwiegenden Folgen wie Lähmungen oder schweren Sehstörungen führen kann. Jüngste Arbeiten von Bjornevik und Kollegen (Bjornevik et al., Science 2022) haben den kausalen Zusammenhang zwischen einer EBV-Infektion und der Entwicklung von Multipler Sklerose nachgewiesen und damit frühere Berichte bestätigt, die infektiöse Mononukleose als Risikofaktor für MS zeigten. Trotz der vielen vorgeschlagenen Funktionen, die EBV in der Pathogenese dieser neurodegenerativen Autoimmunerkrankung spielt, gibt es derzeit nur wenige Beweise.
Unser Labor hat in Zusammenarbeit mit 10 anderen Forschungsgruppen aus ganz Europa eine Finanzierung im Rahmen des Programms Horizont Europa erhalten, um neue Erkenntnisse darüber zu gewinnen, wie die Interaktion von EBV mit dem Wirt die Entwicklung von MS fördern kann. Das BEHIND MS-Konsortium, bei dem unsere Gruppe als Koordinator fungiert, wird durch die Zusammenführung komplementärer Fachkenntnisse in vitro, ex vivo und in vivo die Mechanismen untersuchen, die der pathogenen Rolle von EBV bei Multipler Sklerose zugrunde liegen, mit dem Ziel, neue medikamentöse therapeutische Ziele und Biomarker zu ermitteln, um die Diagnose, die Stadieneinteilung und die Behandlung dieser noch unheilbaren Krankheit zu verbessern.

Patienten mit einer Immunschwäche und insbesondere Transplantatempfänger haben eine verminderte Fähigkeit, Infektionserreger zu kontrollieren. Bei einer verminderten funktionellen T-Zell-Antwort kann ein erheblicher Teil der Personen, die zuvor mit EBV infiziert waren, die erneute Vermehrung infizierter B-Zellen nicht verhindern (Abbildung 1). Transplantatempfänger, insbesondere Kinder, die sich einer Primärinfektion unterziehen, während sie bereits immunsuppressiv behandelt werden, tragen ein noch höheres Risiko für EBV-assoziierte Krankheiten wie Posttransplantations-Lymphoproliferative Erkrankung (PTLD). Wir haben bereits die Virusstämme untersucht, die in EBV-assoziierten Nasopharynxkarzinomen und Magenkarzinomen vorkommen, und festgestellt, dass diese Stämme spezifische Eigenschaften aufweisen (Tsai et al. Cell reports 2013, Shumilov, Tsai et al Nature comm. 2017). Wir untersuchen nun die Hypothese, dass das Risiko einer PTLD mit Infektionen mit EBV-Stämmen verbunden ist, die über eine höhere Transformationsfähigkeit verfügen. Wir haben ein Kollektiv von Patienten mit EBV-Reaktivierung nach Transplantation rekrutiert und mit EBV infizierte Zelllinien aus deren peripherem Blut etabliert. Wir wollen mehrere Parameter wie virale und zelluläre Proteine, die an der EBV-vermittelten Transformation beteiligt sind, und die Expression von microRNA in Primärzellen und in den Zelllinien, die von diesen Patienten hergestellt wurden, untersuchen.
Dieses Projekt ist das Ergebnis einer engen Zusammenarbeit mit dem Nierenzentrum Heidelberg, der Abteilung für Hämatologie sowie dem Institut für Virologie der Universität Heidelberg.
Die akute myeloische Leukämie (AML) macht 80 % der akuten Leukämiefälle bei Erwachsenen aus und entsteht durch die Anhäufung unreifer, bösartiger myeloischer Zellen auf Kosten gesunder, differenzierter Gegenspieler. Die Behandlungsmöglichkeiten für AML sind nach wie vor begrenzt. Während bei Patienten unter 65 Jahren ein mäßiger Therapieerfolg zu verzeichnen ist, erliegen etwa 70 % der älteren Patienten der Krankheit innerhalb eines Jahres nach der Diagnose. Daher ist die Suche nach weiteren therapeutischen Optionen für die AML zwingend erforderlich.
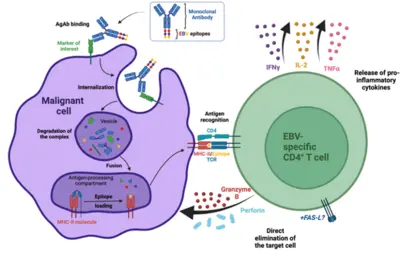
Unser Labor hat eine Plattform für die effiziente Übertragung immundominanter viraler Epitope auf Tumorzellen entwickelt. Der Ansatz basiert auf mit Antigen beladenen Antikörpern (AgAbs), die Antigene des Epstein-Barr-Virus (EBV) tragen. Mit Hilfe dieser Strategie werden bösartige Zellen für das Immunsystem sichtbar und werden von EBV-spezifischen CD4+ zytotoxischen T-Zellen angegriffen. Die AgAbs binden an Oberflächenmoleküle, die von den bösartigen Zellen exprimiert werden, und lösen eine rezeptorvermittelte Endozytose aus. Infolgedessen werden die in den AgAbs enthaltenen viralen Peptide in die endosomalen Kompartimente der Zielzellen transportiert, wo die Epitope für die MHC-Klasse-II-gebundene Präsentation auf der Zelloberfläche verarbeitet werden können. Bei EBV-positiven Personen erkennen zirkulierende virusspezifische zytotoxische CD4+ T-Zellen die MHCII-gebundenen Peptide auf der Oberfläche von Tumorzellen und vermitteln die Zelllyse.
Wir haben AgAbs entwickelt, die speziell auf AML- und Leukämie-Stammzellen abzielen. Dieser Ansatz ist sinnvoll, da ein hoher Prozentsatz der AML-Zellen funktionelle MHC-II-Moleküle exprimieren und mehrere spezifische Membranrezeptoren hochregulieren. Unsere ersten Experimente deuten darauf hin, dass die AgAb-Strategie bei AML vielversprechend ist. In der Tat können AgAbs primäre AML-Zellen in vitro und ex vivo eliminieren. Darüber hinaus führte dieser therapeutische Ansatz zu einem starken Überlebensvorteil in einem murinen AML-Modell.
Team
- Profil anzeigen

Prof. Dr. Henri-Jacques Delecluse
Group Leader
- Profil anzeigen

Jonathan Till Abele
PhD student
- Profil anzeigen

Dr. Francesco Baccianti
Postdoctoral scientist
- Profil anzeigen

Bowen Bai
PhD student
-
Lisa David
- Profil anzeigen
Dr. Susanne Delecluse
Clinical scientist, Group Leader NZ/DKFZ Cooperation Unit
- Profil anzeigen
Elise Dondelot
PhD student
- Profil anzeigen

Nicole Feichtgruber
PhD student
- Profil anzeigen

Gesa Frese
Project Manager, BEHIND-MS Consortium
- Profil anzeigen

Jasmin Fuchs
Technician
- Profil anzeigen

Qipeng Hu
PhD student
- Profil anzeigen
Difei Hu
Bachelor student
- Profil anzeigen

Dr. Chih-Ying Lee
Postdoctoral scientist
- Profil anzeigen

Hao Li
PhD student
- Profil anzeigen

Helge Lips
Technician
- Profil anzeigen

Shutao Ma
PhD student
- Profil anzeigen
Louna Oviève
MD student
- Profil anzeigen

Guangsen Pan
PhD student
- Profil anzeigen

Remy Poirey
Scientific employee
-
Timo Quarneti
- Profil anzeigen

Millie Robinson
PhD student
- Profil anzeigen
Ines Ruxer
PhD student
- Profil anzeigen

Dr. Guillaume Wassmer
Postdoctoral scientist
- Profil anzeigen

Shuang Yang
PhD student
Ausgewählte Publikationen
Baccianti F, Masson C, Delecluse S, Li Z, Poirey R, Delecluse H-J
Li Z, Tsai MH, Shumilov A, Baccianti F, Tsao SW, Poirey R, Delecluse HJ
Schneidt V, Ilecka M, Dreger P, van Zyl DG, Fink S, Mautner J, Delecluse HJ
Shumilov A, Tsai MH, Schlosser YT, Kratz AS, Bernhardt K, Fink S, Mizani T, Lin X, Jauch A, Mautner J, Kopp-Schneider A, Feederle R, Hoffmann I, Delecluse HJ
Kontaktieren Sie uns

