Hirngenom-Mosaizismus und Tumorgenese
- Funktionelle und Strukturelle Genomforschung
- Nachwuchsgruppe

Dr. Pei-Chi Wei
Principal Investigator
Nicht alle Gehirnzellen haben die gleiche DNA. Einige dieser Veränderungen entstehen früh im Leben und könnten eine Rolle bei der Entstehung von Krankheiten wie Krebs spielen. Unser Labor untersucht, wie diese DNA-Veränderungen entstehen, wie sie an andere Zellen weitergegeben werden und wie sie sich im Gehirn ausbreiten.

- Unser Auftrag: die Rolle der DNA-Vielfalt für die Gesundheit des Gehirns entschlüsseln
- Projekte 1: Besteht die Gefahr, dass Zellen ihre DNA beschädigen, wenn sie sich teilen?
- Projekt 2: Die Häufigkeit der Teilung neuronaler Stammzellen beeinflusst die Gesundheit des Gehirns.
- Team
- Ausgewählte Publikationen
- Kontakt
Unser Auftrag: die Rolle der DNA-Vielfalt für die Gesundheit des Gehirns entschlüsseln
Die Gehirnentwicklung ist ein dynamischer Prozess
Das menschliche Gehirn besteht aus Milliarden von Neuronen und Astrozyten, die durch Hunderte von Teilungen aus neuralen Vorläuferzellen entstehen. Bemerkenswerterweise bilden sich die meisten dieser Zellen innerhalb von nur 24 Wochen während der fötalen Entwicklung. Dieser Prozess ist sowohl zeitlich als auch räumlich sorgfältig orchestriert und formt das etwa 400 g schwere Gehirn des Neugeborenen.
Mein Labor erforscht grundlegende Fragen: Woher wissen neurale Vorläuferzellen, wann sie aufhören sollen, sich zu teilen? Warum und wie verlängern sie ihre Zellzyklen? Erhöht eine schnelle Zellteilung die DNA-Schäden in diesen Zellen? Das Verständnis dieser Mechanismen ist der Schlüssel zur Aufdeckung der Entstehung, des Fortschreitens und der Entwicklung von Hirnkrebs.
Methoden und Technologien
Wir haben experimentelle und analytische Instrumente entwickelt, um die Wechselwirkungen zwischen den zellulären Maschinen aufzudecken, die für das Kopieren und Ablesen von DNA-Sequenzen verantwortlich sind. Mit Hilfe von Hochdurchsatz-Sequenzierungstechnologien messen wir den Zeitpunkt und die Geschwindigkeit der DNA-Replikation und untersuchen den Transkriptions-„Verkehr“, der durch die Maschinerie zur Entschlüsselung der DNA entsteht.
Darüber hinaus erstellen wir Mausmodelle, um zu untersuchen, wie neuronale Stammzellen während der frühen Gehirnentwicklung um Platz und Ressourcen konkurrieren. Im Rahmen unserer Arbeit entwerfen wir auch experimentelle Systeme, die es uns ermöglichen, „in der Zeit zurückzureisen“ und das Verhalten neuraler Stammzellen in späteren Lebensstadien zu verfolgen.
Ziele und gesellschaftliche Bedeutung
Die Prävention von Hirntumoren steht vor großen Herausforderungen, da wir nur begrenzt verstehen, wie frühe zelluläre Prozesse zur Tumorbildung beitragen. Unser Ziel ist es, diese Lücke zu schließen, indem wir herausfinden, wie neurale Stamm- und Vorläuferzellen die Entwicklung des Gehirns vorantreiben und dabei die DNA-Integrität erhalten. Durch die Untersuchung der Mechanismen der klonalen Expansion, der zellulären Konkurrenz und der genomischen Stabilität wollen wir wichtige Risikofaktoren identifizieren und Strategien zur Verhinderung von Hirntumoren entwickeln. Durch diese Arbeit wollen wir die Gesundheit des Gehirns fördern und die gesellschaftlichen Auswirkungen neurologischer Erkrankungen verringern.
Kreativität und Neugierde sind wichtig

Unser Labor schätzt individuelle Perspektiven bei der Bewältigung wissenschaftlicher Herausforderungen und fördert eine Kultur der kollektiven Kreativität. Wir legen Wert auf Zusammenarbeit und offenen Dialog in einer sicheren, urteilsfreien Umgebung. Wir sind davon überzeugt, dass Kreativität durch die Kombination von persönlichen Erfahrungen und Wissen gedeiht und durch die Nutzung der Erkenntnisse und des Fachwissens anderer bereichert wird.
Mein Labor erforscht verschiedene Aspekte des Gehirnmosaiks, angetrieben von Neugier und Kreativität in einem interdisziplinären Ansatz. Hier sind zwei Beispiele für unsere Forschungsrichtungen:
Projekte 1: Besteht die Gefahr, dass Zellen ihre DNA beschädigen, wenn sie sich teilen?
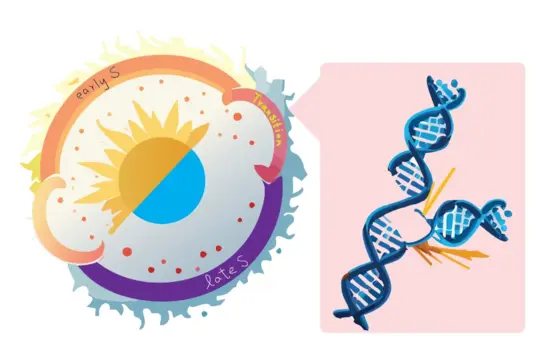
Unsere Forschung konzentriert sich darauf zu verstehen, wie DNA-Schäden in neuronalen Stammzellen entstehen und wie dies zu Hirnstörungen und Krebs beitragen kann. Lange Gene, die wichtige neuronale Funktionen wie Zellkommunikation und Plastizität steuern, sind besonders anfällig für DNA-Schäden. Aber warum sind diese Gene Hotspots für solche Veränderungen?
Wir entdeckten bestimmte Regionen in der DNA, die häufig brechen, insbesondere in langen Genen, die für Gehirnfunktionen wie Kommunikation und Anpassungsfähigkeit wichtig sind. Diese fragilen Regionen werden unter Stress während der DNA-Verdopplung anfälliger und stehen in Verbindung mit neuropsychiatrischen Störungen, Krebs und gemeinsamen DNA-Veränderungen in Neuronen, die von denselben Vorläufern stammen.
Wir haben herausgefunden, dass diese DNA-Brüche dort auftreten, wo das Kopieren der DNA und das Lesen ihres Codes kollidieren. In diesen Bereichen fehlen die Mittel, um den ins Stocken geratenen Kopierprozess zu reparieren, wodurch sie besonders anfällig für Schäden sind. Mithilfe fortschrittlicher Techniken konnten wir zeigen, dass sich diese Brüche oft so ausrichten, dass sie große Deletionen in kritischen Genen verursachen.
Wir untersuchen, ob diese DNA-Schäden eine Rolle bei der Diversifizierung der Genome von neuronalen Gründerzellen spielen und ob Deletionen in kritischen Genen zur Tumorentwicklung beitragen.
Projekt 2: Die Häufigkeit der Teilung neuronaler Stammzellen beeinflusst die Gesundheit des Gehirns.
Unsere Forschung befasst sich mit der Frage, wie sich die Größe von neuronalen Stammzellklonen auf die Struktur und Funktion des Gehirns auswirkt. Neurale Stammzellklone sind Gruppen von Neuronen, die denselben DNA-Bauplan haben, und ihre Größe hat direkten Einfluss auf die räumliche Organisation und funktionelle Vielfalt der Neuronen im Gehirn. Interessanterweise zeigen Studien, dass die Größe der neuronalen Klone in den verschiedenen Gehirnregionen variiert, was darauf hindeutet, dass die Größe der Klone eine Schlüsselrolle bei der Anpassung der Gehirnarchitektur an die jeweiligen Bedürfnisse spielt.
Mein Labor entwickelt präklinische Instrumente und Modelle, um die klonale Expansion, Selektion und Evolution im sich entwickelnden Gehirn zu untersuchen. Wir konzentrieren uns darauf, die Auslöser der klonalen Konkurrenz zu identifizieren - ein Prozess, der zu unregulierter, übermäßiger Zellproliferation führen kann, auch bekannt als präkanzeröse Hyperproliferation.
Unser Ziel ist es, festzustellen, ob eine solche unkontrollierte Vermehrung in normalem Gewebe das Risiko der Krebsentwicklung erhöht. Letztlich könnte diese Forschung neue Risikofaktoren aufdecken und Strategien zur Verhinderung von Hirntumoren aufzeigen.
Team
Kurzer Beschreibungstext zur Vorstellung der Teammitglieder.
-

Dr. Pei-Chi Wei
Principal Investigator
-
Jana Berlanda
-

Lorenzo Corazzi
Ph.D. student
-

Giulia Di Muzio
Ph.D. student
-

Boyu Ding
Ph.D. student
-

Marco Giaisi
Lab Manager
-
Hsin-Jui Lu
-
Anna Marx
-

Li-Chin Wang
Data scientist
Associated team members
Michael Allers
M.D. student with Prof. Dr. Dr. Peter Huber (E055)
E-mail: m.allers(at)dkfz-heidelberg.de
Phone: +49 6221 42 3249
Ausgewählte Publikationen
Giulia Di Muzio, Sarah Benedetto, Li-Chin Wang, Lea Weber, Franciscus van der Hoeven, Brittney Armstrong, Hsin-Jui Lu, Jana Berlanda, Verena Körber, Nina Claudino, Michelle Krogemann, Thomas Höfer, Pei-Chi Wei
Craig J Anderson, Lana Talmane, Juliet Luft, John Connelly, Michael D Nicholson, Jan C Verburg, Oriol Pich, Susan Campbell, Marco Giaisi, Pei-Chi Wei, Vasavi Sundaram, Frances Connor, Paul A Ginno, Takayo Sasaki, David M Gilbert, Núria López-Bigas, Colin A Semple, Duncan T Odom, Sarah J Aitken, Martin S Taylor
Aseda Tena, Yuxiang Zhang, Nia Kyritsis, Anne Devorak, Jeffrey Zurita, Pei-Chi Wei (co-correspondence) Frederick W. Alt
Pei-Chi Wei, Amelia N Chang, Jennifer Kao, Zhou Du, Robin M Meyers, Frederick W Alt, Bjoern Schwer
Kontaktieren Sie uns

