GMP & T-Zelltherapie
- Immunologie, Infektion und Krebs

Prof. Dr. Stefan Eichmüller
Arbeitsgruppenleiter
Die Verwendung von Immuntherapeutika stellt eine vielversprechende Behandlungsstragie gegen Krebs dar, wie der therapeutische Erfolg von Checkpoint-Inhibitoren zeigt. Die Forschungsgruppe „GMP & T-Zelltherapie“ untersucht die Funktionsweisen der T-Zell-vermittelten Tumorabstoßung und erarbeitet neue Konzepte für deren klinische Anwendung.
Bild: Created in BioRender. https://BioRender.com/h43b574 ,

Bild: Created in BioRender. https://BioRender.com/h43b574 ,
Unsere Forschung
Unsere Arbeitsgruppe erforscht verschiedene Möglichkeiten zur Optimierung der T-Zell-vermittelten Tumor-Abwehr und bereitet zusammen mit klinischen Kooperationspartnern deren Anwendung vor. Hierbei untersuchen wir in unserer translationalen Forschung verschiedene Aspekte der T Zell-vermittelten Immunantwort.
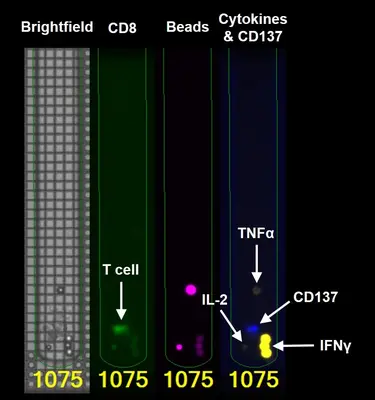
Ein wichtiger Aspekt ist die detaillierte Analyse individueller T Zellen aus dem Tumor bezüglich ihrer Fähigkeit, Tumorzellen zu erkennen und zu zerstören. Das Bruker Lightning System ermöglicht solche Einzelzellanalysen auf einem Chip. Hierbei werden parallel 1500 T Zellen in einzelnen Kammern des Chips auf ihre Reaktivität gegen autologe Tumorzellen (d.h. Tumorzellen, die aus demselben Patienten stammen) untersucht. Reaktive T Zellen können anschließend einzeln aus dem Chip exportiert werden, um die genetische Sequenz des reaktiven T-Zellrezeptor zu bestimmen. Das identifizierte TCR Gen wird kloniert und in autologen T Zellen zur Ausprägung gebracht. Die somit entstandenen TCR-T Zellen werden auf die funktionelle Erkennung autologer Tumorzellen getestet. Dieser Ansatz wird aktuell in hämatologischen Tumoren (Multiples Myelom) und in soliden Tumoren wie dem Ovarialkarzinom angewendet (siehe Projekt “Tumor-spezifische TCRs”).
Gerade solide Tumoren zeichnen sich häufig durch ein immunsuppressives Tumor-Milieu aus, das durch die Ansammlung suppressiver Zelltypen und hemmender Faktoren, die vom Tumor ausgeschüttet werden, aufrechterhalten wird. Ein weiteres Projekt unserer Arbeitsgruppe erforscht daher miRNAs, die das immunsuppressive Tumor-Milieu beeinflussen können (siehe Projekt “miRNAs”).
Für die Analyse spezifischer T Zellantworten sind synthetische Peptide notwendig, die in unserem Peptid-Labor herstellt werden (siehe “Peptid Unit”). Parallel dazu etabliert das Team der Peptid Unit derzeit eine GMP-konforme Peptid-Produktion und Qualitätskontrolle für die Anwendung am Patienten im Rahmen von Vakzinierungsstudien.
Unser GMP Team optimiert gegenwärtig Produktionslinien zur Herstellung zellulärer Produkte für den adoptiven T Zelltransfer. Die Produktionslinien umfassen die Expansion Tumor-infiltrierender Lymphozyten, die Herstellung von CAR T Zellen sowie von TCR transgenen T Zellen (siehe “GMP Unit”). Dies geschieht in enger Zusammenarbeit mit dem Team von Prof. Dirk Jäger am NCT. Aktuell befindet sich eine neue GMP Anlage mit Reinräumen zur Herstellung zellulärer Produkte für die klinische Erprobung im Bau.
Projekte

Generierung TCR optimierter T Zellen zur Tumorbehandlung
Der adoptive T-Zell-Transfer gilt derzeit als die erfolgreichste Behandlungsstrategie in der Krebstherapie, vorausgesetzt, die übertragenen T-Zellen erkennen mutierte Epitope, so genannte Neo-Epitope, die von den Tumorzellen präsentiert werden. Die wesentlichen Herausforderungen der adoptiven T-Zell-Therapie bestehen in der Definition tumorspezifischer Zielstrukturen sowie der direkten Identifizierung tumorspezifischer T-Zellen und ihres T-Zell-Rezeptors (TCR). In diesem Verbundprojekt wollen wir Myelom-spezifische T-Zellen, die aus dem Knochenmark von Patienten isoliert wurden, direkt identifizieren. Da die Knochenmarkaspirate sowohl Tumorzellen als auch T-Zellen enthalten, können sie zum Screening auf autologe, tumorspezifische T-Zellen verwendet werden. Wir verwenden das Bruker „Lightning™ Optofluidic System“, ein Tischgerät, das die individuelle Analyse von mehreren tausend Zellen in separaten Kammern auf einem Chip ermöglicht. Die funktionelle Interaktion zwischen sortierten Myelomzellen und einzelnen T-Zellen wird durch Quantifizierung der von reaktiven T-Zellen ausgeschütteten Zytokine analysiert. In einem nächsten Schritt werden die somit erfassten T-Zellen für die TCR-Sequenzierung aus dem Chip isoliert und DNA-Vektoren erzeugt, die für die identifizierten TCRs kodieren. Schließlich wird die Tumor-Reaktivität dieser TCRs gegen autologe Myelomzellen getestet. Letztlich könnten solche Strategien zur Erzeugung autologer, TCR-transgener T-Zellen für die adoptive T-Zell-Therapie von Patienten mit multiplem Myelom eingesetzt werden. Inzwischen haben wir die Anwendung das Bruker „Lightning™ Optofluidic System“ auf die Identifizierung und Isolierung Tumor-spezifischer T Zellen aus soliden Tumoren wie dem Ovarialkarzinom und dem kolorektalen Karzinom ausgeweitet.
Identifizierung und Charakterisierung pan-funktionaler miRNAs
Ein weiterer Aspekt unserer Forschungsaktivitäten befasst sich mit der Identifizierung und Charakterisierung pan-funktionaler miRNA Moleküle (miRNAs).
MikroRNAs (miRNAs) sind kleine, nicht kodierende RNA Moleküle, die gezielt an mRNA Sequenzen bestimmter Gene binden und dadurch deren Expression auf post-transkriptionaler Ebene inhibieren. Tumorzellen weisen häufig ein dereguliertes miRNA Expressionsmuster auf, in dem sowohl Tumorwachstumsfördernde (oncomiRs) als auch Tumor-suppressive miRNAs (tumor suppressor miRs) eine Rolle spielen. In Tumor-assoziierten Makrophagen (TAMs) wurden darüber hinaus miRNAs beschrieben, die in immun-stimulatorischen (M1-artigen) bzw. in immunsuppressiven (M2-artigen) TAMs überexprimiert vorliegen und außerdem die funktionelle Polarisierung in M1- bzw. M2- artige TAMs vorantreiben.
Anhand eines miRNA Library Screenings und molekularbiologischer Untersuchungen (Durchflusszytometrie, qPCR, Western Blot, Reporter Assays) in humanen Tumorzelllinien und primären Makrophagen identifizieren und charakterisieren wir spezielle miRNAs, die sowohl in Tumorzellen als auch in Tumor assoziierten Makrophagen (TAMs) anti-tumorale Effekte auslösen und daher von uns als pan-funktionale miRNAs bezeichnet werden. Pan-funktionale miRNAs verfügen somit möglicherweise über einen therapeutischen Verstärkereffekt, der von klinischer Bedeutung sein könnte.

Die GMP Unit ermöglicht die Durchführung von Therapiestudien an Patienten mit in vitro expandierten Immunzellen. Voraussetzung für die Anwendung als Prüfpräparat ist eine Herstellungserlaubnis nach dem Arzneimittelgesetz (AMG), die die Isolierung, Aufreinigung und Expansion von Immunzellen aus dem Patienten erlaubt. Die GMP-Einheit hat in der Vergangenheit eine Herstellungserlaubnis für „autologe ex vivo reaktivierte tumorspezifische T-Zellen zur adoptiven T-Zelltransfusion“ sowie für „autologe ex vivo expandierte tumorinfiltrierende Zellen zur adoptiven T-Zelltransfusion“ erhalten. Aktuell beschäftigt sich die GMP Einheit mit der Optimierung der Expansionsprotokolle von transgenen und nicht-transgenen autologen T Zellen zur Anwendung in klinischen Studien. In Kooperation mit Prof. Dirk Jäger entsteht hierfür ein neues Zentrum für innovative Therapien (CIT), das Reinräume für die GMP-konforme Synthese und Abfüllung von komplexen Peptidvakzinen, Reinräume für die Produktion von T-Zellpräparaten sowie Labore für die molekulare Charakterisierung und Qualitätskontrolle der Prüfpräparate bereits tellt. Wie arbeiten außerdem eng mit der Arbeitsgruppe von Dr. Patrick Schmidt für die Herstellung transgener T Zellprodukte zusammen (Link zur Homepage).
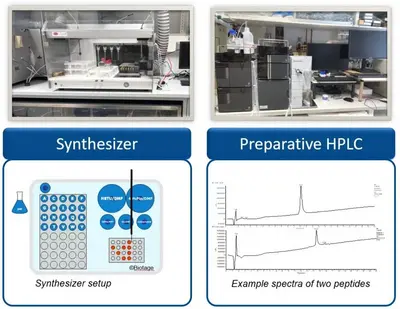
Produktion und Qualitätskontrolle von synthetischen Peptiden für die Forschung
Die Entwicklung neuartiger Immuntherapien ist oft auf eine schnelle und kostengünstige Herstellung kurzer (8 - 11 aa für MHC I-Epitope) und langer (13 - 25 aa für MHC II-Epitope) Peptide angewiesen. Zu diesem Zweck verfügt die Arbeitsgruppe GMP & T-Zelltherapie über ein eigenes Peptidlabor (Peptid Unit) für die parallele Synthese und Aufreinigung von mehreren hundert Peptiden pro Jahr.
Die synthetisierten Peptide werden in Forschungsprojekten verschiedener DKFZ-Gruppen für unterschiedliche Zwecke eingesetzt, wie z.B. zur Validierung von Immun-Epitopen, MHC-Multimer-Färbung, Herstellung Peptid-beladener Antigen-präsentierender Zellen (APCs) für funktionelle T-Zell-Assays sowie der therapeutischen Vakzinierung von Mäusen.
Routinemäßig werden Peptide aus den 20 proteinogenen Aminosäuren hergestellt. Auf Anfrage können aber auch kundenspezifische Modifikationen (z. B. Fluorophor-gekoppelte Peptide, D-Aminosäuren, Zyklisierungen, Sonderbausteine) angeboten werden. Zudem bietet das Peptidlabor Servicedienstleistungen z.B. bei der Bewertung von Herstellbarkeit, Stabilität und Löslichkeit von Peptiden an.
Synthese und Aufreinigung
Die Peptidsequenzen werden mittels Festphasensynthese unter Verwendung der Fmoc-Strategie an einem vollautomatischen Mehrfachsynthesizer hergestellt. Die Synthese erfolgt dabei auf unterschiedlichen polymeren Trägern (Polystyrol, PEG) und unter Verwendung geeigneter Aktivatoren (Carbodiimide, Phosphonium-, Aminiumsalze). Zur Vermeidung von Deletionssequenzen werden unvollständige Sequenzen nach jedem Zyklus acetyliert (Capping). Nach der Abspaltung der fertigen Sequenzen vom Träger mit Trifluoressigsäure, erfolgt eine optionale Reinigung der Rohpeptide durch präparative Umkehrphasenchromatographie unter Verwendung eines Wasser/Acetonitril Gradienten. Für eine optimale Stabilität werden die fertiggestellten Peptide anschließend gefriergetrocknet.
Qualitätskontrolle
Alle Peptide werden routinemäßig mittels analytischer LC-MS (Dionex UltiMate 3000) überprüft: Die Reinheit der Peptide wird dabei mittels chromatographischer Trennung und Detektion der Absorption bei 215 nm bestimmt, der Identitätsnachweis erfolgt an einem gekoppelten linearen Ionenfallen-Massenspektrometer (ThermoFisher LTQ XL).
GMP-Peptide für Peptid-Vakzinierungen
Ein vielversprechender Ansatz für die Tumorbehandlung ist die Peptidvakzinierung mit patientenindividuellen Neoepitopen, die bei Patienten oft langanhaltende Immunantworten induzieren kann. Für eine Anwendung am Menschen müssen Peptide jedoch unter den strengen Hygienestandards der Good Manufacturing Practice (GMP) einschließlich der Verwendung einer Reinraumumgebung und erweiterten Qualitätskontrollmaßnahmen hergestellt werden. Das Peptidlabor arbeitet an der Anpassung des Produktionsprozesses an die GMP-Anforderungen, um die Synthese von Peptiden als Wirkstoffe für klinische Studien zu realisieren.
Journal Club Krebsimmuntherapie
Wir bieten einen wöchentlichen Journal Club zum Thema „Krebsimmuntherapie“ an, der montags um 9.00 Uhr mit Personen aus verschiedenen Abteilungen und Forschungsprogrammen des DKFZ und NCT stattfindet. Die Seminarteilnehmer sind Master- und PhD-Studenten, Postdocs und Gruppenleiter. Unser Ziel ist es, die neueste Literatur auf dem Gebiet der Krebsimmuntherapie konstruktiv zu diskutieren.
Jeder Teilnehmer stellt etwa zweimal im Jahr eine Arbeit in einer 30- bis 40-minütigen Powerpoint-Präsentation vor. Die Veröffentlichung wird im Anschluss von allen Teilnehmern diskutiert. Der Journal Club findet virtuell als Videokonferenz mit anschließender Diskussion aller Teilnehmer statt.
Wenn Sie Interesse an einer Teilnahme haben, wenden Sie sich bitte an Stefan Eichmüller, der dieses Seminar organisiert. Die Teilnahme kann im Rahmen des PhD-Programms bestätigt werden.
Hier geht es zur Liste der vorgestellten Artikel.
Lehre
Unser Team ist kontinuierlich an verschiedenen Lehrtätigkeiten beteiligt.
Journal Club Krebsimmuntherapie
Wir bieten einen wöchentlichen Journal Club zum Thema „Krebsimmuntherapie“ mit Teilnehmern aus verschiedenen Abteilungen und Forschungsschwerpunkten des DKFZ und NCT sowie der Universität Heidelberg an. Weitere Details finden im Abschnitt Journal Club Krebsimmuntherapie.
Major Cancer Biology
Gemeinsam mit anderen Abteilungen organisieren und leiten wir das Modul HP-F11 „Immunological Methods” das Teil des „Focus Bioscience 1&2” ist. Dazu gehören Vorlesungsreihen und Tutorien zum Thema „Tumorimmunologie, Virologie und Krebs“ sowie die Betreuung von Studenten während eines Praktikums (Prof. S. Eichmüller, Dr. W. Osen). Weitere Details zum Major Krebsbiologie finden Sie hier.
Praktikum/ Masterarbeit
Studenten des Masterstudiengangs „Molecular Bioscience” der Universität Heidelberg, Fakultät für Biowissenschaften, können in unserer Gruppe ein Praktikum absolvieren. Um eine optimale Betreuung zu gewährleisten, ist dies auf jeweils einen Studenten beschränkt. Es ist außerdem möglich, eine Masterarbeit in unserer Gruppe anzufertigen.
Prof. Dr. Stefan Eichmüller
Unten finden Sie den Lebenslauf von Prof. Eichmüller als PDF-Download.

Team GMP & T Zelltherapie
Unsere Arbeitsgruppe besteht aus verschiedenen Untereinheiten: die wissenschaftliche Arbeitsgruppe und GMP Unit, die sich aktuell im Haupthaus befinden, sowie die Peptid Unit im Gebäude TP4 des Technologieparks.
Für mehr Informationen folgen Sie dem untenstehenden Link "Gesamtes Team".
-

Prof. Dr. Stefan Eichmüller
Arbeitsgruppenleiter
-

Dr. Yannic Altrichter
Projektmanager Peptidherstellung
-

Felix Andres
PhD Student
-

Kai Beißer
Technische Assistenz Peptide
-

Chantal Crocoll
Bachelor Peptide
-

Elke Dickes
Technische Assistenz Wissenschaft, GMP
-

Sabrina Kempf
Technische Assistenz GMP
-

Dr. Bettina Meißburger
Projektmanager GMP, Zelltherapie
-

Robin Mölle
Technische Assistenz Peptide
-

Wolfgang Müller
Technische Assistenz GMP
-

Dr. Wolfram Osen
Gruppenleiter präklinische Forschung
-

Rainer Schell
Technische Assistenz GMP
-

Dr. Patrick Schmidt
Gruppenleiter transgene T-Zelltherapie
-
Fabian Sieker
-

Claudia Sterzik-Luksch
Technische Assistenz GMP
-

Julian Thimm
Projektmanager GMP Compliance
Alumni
Ehemalige Mitglieder der Arbeitsgruppe finden Sie unter Alumni.
Publikationen
2025
- Roberti MP, Charoentong P, Lyu Y, Meyer M, Eichmüller SB, Schmidt P, Momburg F, Cetin M, Hartmann F, Valous NA, Stenzinger A, Michel L, Lichter P, Schneeweiss A, Thewes V, Fremd C, Zörnig I, and Jäger D (2025) Isolation of a tumor neoantigen specific CD8+ TCR from a skin biopsy of a vaccination site. Oncoimmunology 14: 2457793. Link to full text
- Laurent PA, Andre F, Bobard A, Deandreis D, Demaria S, Depil S, Eichmüller SB, Fernandez-Palomo C, Foijer F, Galluzzi L, Galon J, Guckenberger M, Harrington KJ, Herrera FG, Huber PE, Italiano A, Karam SD, Kroemer G, Lambin P, Leuschner C, Mantovani A, Meylan E, Mondini M, Pittet MJ, Pouget JP, Remon J, Sorensen CS, Sotiriou C, Vanpouille-Box C, Weichselbaum RR, Welsh JW, Zitvogel L, Formenti SC, and Deutsch E (2025) Pushing the boundaries of radiotherapy-immunotherapy combinations: highlights from the 7(th) immunorad conference. Oncoimmunology 14: 2432726. Link to full text
2024
- Wang Y, Lazaridou M-F, Kordaß T, Massa C, Vaxevanis CK, Riemann D, Eichmüller S, and Barbara S (2024) Unconventional microRNA role: Enhancing the human leukocyte antigen class I antigen processing pathway via interacting with a silencer. Clin Transl Med 14: e70010.
- Schmidt P, Eichmüller SB, Sun Y-F, and Scolnick J (2024) Personalized Immunotherapy: Advancing processes to extend patient collectives. Frontiers Media SA
- Meyer M, Parpoulas C, Barthelemy T, Becker JP, Charoentong P, Lyu Y, Borsig S, Bulbuc N, Tessmer C, Weinacht L, Ibberson D, Schmidt P, Pipkorn R, Eichmüller SB, Steinberger P, Lindner K, Poschke I, Platten M, Fröhling S, Riemer AB, Hassel JC, Roberti MP, Jäger D, Zörnig I, and Momburg F (2024) MediMer: a versatile do-it-yourself peptide-receptive MHC class I multimer platform for tumor neoantigen-specific T cell detection. Front Immunol 14: 1294565. Link to full text
2023
- Kordaß T, Chao T-Y, Osen W, and Eichmüller SB (2023) Novel microRNAs modulating ecto-5′-nucleotidase expression. Front. Immunol. 14. Link to full text
- Pane AA, Kordaß T, Hotz-Wagenblatt A, Dickes E, Kopp-Schneider A, Will R, Seliger B, Osen W, and Eichmüller SB (2023) miRNAs affecting the susceptibility of melanoma cells to CD8+ T cell-mediated cytolysis. Clin Transl Med 13(2): e1186. Link to full text
- Chao T-Y*, Kordaß T*, Osen W, and Eichmüller SB (2022) SOX9 is a target of miR-134-3p and miR-224-3p in breast cancer cell lines. Mol Cell Biochem 478(2):305-315. Link to full text
2022
- Hartmann L, Osen W, Eichmüller OL, Kordaß T, Furkel J, Dickes E, Reid C, Debus J, Brons S, Abdollahi A, Moustafa M, Rieken S, and Eichmüller SB (2022) Carbon ion irradiation plus CTLA4 blockade elicits therapeutic immune responses in a murine tumor model. Cancer Lett. 500. Link to full text
- Kehl N, Kilian M, Michel J, Wagner TR, Uhrig S, Brobeil A, Sester LS, Blobner S, Steiger S, Hundemer M, Weinhold N, Rippe K, Fröhling S, Eichmüller SB, Bunse L, Müller-Tidow C, Goldschmidt H, Platten M, Raab MS, and Friedrich M (2022) IgE type multiple myeloma exhibits hypermutated phenotype and tumor reactive T cells. Journal for ImmunoTherapy for Cancer 10. Link to full text
- Kustermann M, Dasari P, Knape I, Keltsch E, Liu J, Pfluger S, Osen W, Holzmann K, Huber-Lang M, Debatin KM, and Strauss G (2022) Adoptively Transferred in vitro-Generated Myeloid-Derived Suppressor Cells Improve T-Cell Function and Antigen-Specific Immunity after Traumatic Lung Injury. J Innate Immun 1-18.
- Hernández-Malmierca P, Vonficht D, Schnell A, Uckelmann HJ, Bollhagen A, Mahmoud MAA, Landua SL, Salm EVd, Trautmann CL, Raffel S, Grünschläger F, Lutz R, Ghosh M, Renders S, Correia N, Donato E, Dixon KO, Hirche C, Andresen C, Robens C, Werner PS, Boch T, Eisel D, Osen W, Pilz F, Przybylla A, Klein C, Buchholz F, Milsom MD, Essers MAG, Eichmüller SB, Hofmann W-K, Nowak D, Hübschmann D, Hundemer M, Thiede C, Bullinger L, Müller-Tidow C, Armstrong SA, Trumpp A, Kuchroo VK, and Haas S (2022) Antigen presentation safeguards the integrity of the hematopoietic stem cell pool. Cell Stem Cell 29(5):760-75 e10 doi: 10.1016/j.stem.2022.04.007.
Kilian M, Friedrich M, Sanghvi K, Green E, Pusch S, Kawauchi D, Löwer M, Sonner JK, Krämer C, Zaman J, Jung S, Breckwoldt MO, Willimsky G, Eichmüller SB, Deimling Av, Wick W, Sahm F, Platten M, and Bunse L (2022) T cell receptor therapy targeting mutant capicua transcriptional repressor in experimental gliomas. Clin Cancer Res 28:378-389.
(*): geteilte Erstautorschaft. Mitglieder der Arbeitsgruppe sind in fettgedruckt.
Kontaktieren Sie uns















