Diffuse Gliome sind meist unheilbare Hirntumoren, die sich im Gehirn ausbreiten und operativ nur schwer vollständig entfernt werden können. Auch Chemo- oder Strahlentherapie sind häufig nur begrenzt wirksam. Krebsmediziner suchen daher dringend nach innovativen Therapieansätzen, die Gliome mithilfe des Immunsystems zu bekämpfen – durch therapeutische Impfungen oder Immuntherapien.
Gliome bestehen keineswegs nur aus Krebszellen: Bis zu 50 Prozent der Tumormasse machen Mikrogliazellen, eine Art hirneigener Fresszellen, sowie über die Blutgefäße eingewanderte Makrophagen aus. Auch Makrophagen zählen zu den Fresszellen, die aber bei der Bekämpfung der Tumorzellen ineffektiv sind.
„Um die Entwicklung von Immuntherapien oder therapeutischen Impfungen voranzubringen, müssen wir genau verstehen, wie sich die Immun-Umgebung während der Entwicklung der Tumoren verhält. Außerdem interessierte uns, ob spezielle genetische Merkmale der Gliome besonderen Einfluss auf die Funktion der Gliom-assoziierten Immunzellen haben“, sagt Michael Platten, Direktor der Klinik für Neurologie der Universitätsmedizin Mannheim, Abteilungsleiter im Deutschen Krebsforschungszentrum und Leiter der aktuellen Studie.
Wissenschaftler aus Plattens Abteilung haben nun gemeinsam mit der Arbeitsgruppe um Marco Prinz, Ärztlicher Direktor am Institut für Neuropathologie Freiburg, eine molekulare „Statusanalyse“ der Gliom-assoziierten Immunzellen veröffentlicht. Dafür untersuchten sie die RNA- sowie Proteinprofile gezielt in einzelnen Mikrogliazellen und Makrophagen. An Tumormodellen in Mäusen konnten sie die Entwicklung der Immun-Umgebung außerdem auch im zeitlichen Verlauf der Erkrankung nachvollziehen.
Stoffwechselprodukt der Gliomzellen lähmt Immunzellen im Gehirn
Besonders interessierten sich die Forscher für Tumoren mit der so genannten IDH-Mutation, die bei etwa 70 Prozent aller sogenannten niedriggradigen Gliome vorliegt. Diese Tumorzellen tragen eine identische Mutation, die dazu führt, dass im Enzym IDH* ein bestimmter Eiweißbaustein ausgetauscht wird.
Als Konsequenz der IDH-Mutation schütten die Gliomzellen das krebsfördernde Stoffwechselprodukt (R)-2-HG aus, das, so entdeckten die Forscher, die einwandernden Makrophagen beeinflusst. Dadurch werden die Fresszellen gewissermaßen umprogrammiert und blockieren eine Immunantwort gegen den Tumor: Sie schütten Botenstoffe aus, die das Immunsystem bremsen, und beeinträchtigen die Aktivität von T-Zellen – Forscher sprechen von einer „Immunparalyse“. „Die IDH-Mutation bewirkt letztendlich, dass sich die Gliome gegen das menschliche Immunsystem schützen können“, sagt Mirco Friedrich, Wissenschaftler am DKFZ und Arzt am Universitätsklinikum Heidelberg, einer der Erstautoren der aktuellen Publikation.
Den molekularen Mechanismus, über den (R)-2-HG die Makrophagen umprogrammiert, konnten die Wissenschaftler daraufhin entschlüsseln: Das das Krebswachstum fördernde Stoffwechselprodukt greift in den Aminosäurestoffwechsel der Fresszellen ein. Die Konsequenz ist, dass ein zentrales Steuerungsmolekül des Immunsystems, der Aryl-Hydrokarbon-Rezeptor, aktiviert wird. Der aktivierte Rezeptor versetzt die Makrophagen in den immunsuppressiven Status.
Gelähmtes Immunsystem wieder reaktivieren
Angesichts dieser zentralen Rolle des Aryl-Hydrokarbon-Rezeptors entschieden die Forscher, die Funktion dieses Schlüsselmoleküls gezielt auszuschalten. Dazu setzten sie einen spezifischen, gemeinsam vom DKFZ und der Firma Bayer entwickelten Wirkstoff ein. Diese Substanz kombinierten sie mit einer speziellen Immuntherapie, einem sogenannten Immun-Checkpoint-Inhibitor. Die Kombination führte im Tiermodell dazu, dass die ansonsten wirkungslose Immuntherapie anschlug und das Leben der Mäuse mit IDH-mutierten Tumoren verlängerte.
„Damit haben damit wir erstmals nachgewiesen, dass sich die „gelähmten“ Gliom-assoziierten Fresszellen mit Medikamenten in IDH-mutierten Gliomen gezielt reaktivieren lassen“, sagt Mirco Friedrich. Roman Sankowski vom Universitätsklinikum Freiburg ergänzt: „Die Arbeit ist ein gutes Beispiel dafür, wie Einzelzelluntersuchungen zu einem Therapiemechanismus führen können.“ Lukas Bunse, Arzt an DKFZ und Universitätsmedizin Mannheim, erklärt: „Wir konnten kürzlich mit einer frühen klinischen Studie belegen, dass eine therapeutische Impfung** gegen IDH-mutierte diffuse Gliome bei den Studienteilnehmern die gewünschte Immunreaktion auslöst. Mit unseren aktuellen Untersuchungen demonstrieren wir nun, wie wir das immunsuppressive Milieu im Gehirn umgehen und die Wirksamkeit dieser Impfung noch weiter verbessern können. Das ist ein ermutigendes Ergebnis, das uns zeigt, dass das Immunsystem dabei helfen kann, diese heute kaum heilbare Erkrankung wirksamer zu bekämpfen.“ Klinische Studien sollen nun zeigen, ob diese Behandlungsstrategie für Gliompatienten eine erfolgversprechende Option ist.
* IDH = Isozitrat-Dehydrogenase
** Michael Platten et al., A vaccine targeting mutant IDH1 in newly diagnosed glioma
Nature 2021, DOI: https://dx.doi.org/10.1038/s41586-021-03363-z
https://www.dkfz.de/de/presse/pressemitteilungen/2021/dkfz-pm-21-17-Impfung-gegen-mutiertes-Protein-erstmals-bei-Hirntumor-Patienten-geprueft.php
Aktuelle Publikation:
Mirco Friedrich, Roman Sankowski, Lukas Bunse, Michael Kilian, Edward Green, Carina Ramallo Guevara, Stefan Pusch, Gernot Poschet, Khwab Sanghvi, Markus Hahn, Theresa Bunse, Philipp Münch, Hagen M. Gegner, Jana K. Sonner, Anna von Landenberg, Frederik Cichon, Katrin Aslan, Tim Trobisch, Lucas Schirmer, Denis Abu-Sammour, Tobias Kessler, Miriam Ratliff, Daniel Schrimpf, Felix Sahm, Carsten Hopf, Dieter H. Heiland, Oliver Schnell, Jürgen Beck, Chotima Böttcher, Camila Fernandez-Zapata, Josef Priller, Sabine Heiland, Ilona Gutcher, Francisco J. Quintana, Andreas von Deimling, Wolfgang Wick, Marco Prinz and Michael Platten: Tryptophan metabolism drives dynamic immunosuppressive
myeloid states in IDH-mutant gliomas.
Nature Cancer 2021, DOI: https://www.nature.com/articles/s43018-021-00201-z
Ein Bild zur Pressemitteilung steht zum Download zur Verfügung:
http://www.dkfz.de/de/presse/pressemitteilungen/2021/bilder/GL261-IDH.png
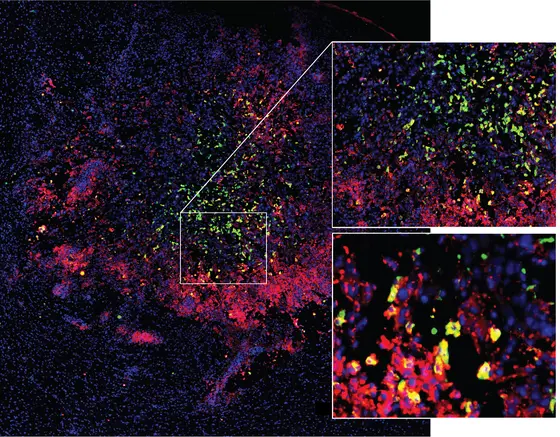
BU: Mikroglia und Makrophagen wandern in einen Hirntumor ein und werden dabei umprogrammiert. Rot: Aktivierter Zustand; grün: Immunsuppressiver, “gelähmter“ Zustand, gelb: Übergang zwischen aktiviertem und immunsuppressivem Zustand.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: Mirco Friedrich / DKFZ“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.