Wenn alles gut geht, hat das Herz bis zum 75. Geburtstag eines Menschen fast 180 Millionen Liter Blut durch den Körper gepumpt. Dafür schlägt es rund 100.000 Mal pro Tag, präzise und unermüdlich, und versorgt so den Körper bis in die kleinste Kapillare mit Sauerstoff und anderen lebensnotwendigen Substanzen. Doch bei bis zu 3 Millionen Menschen in Deutschland schwächelt die Pumpe: Sie leiden unter Herzinsuffizienz und damit unter Atemnot, Wassereinlagerungen und zunehmender Leistungsschwäche. Und letztlich droht der Tod.
„Es ist schon länger bekannt, dass Herzinsuffizienz eine Veränderung im Stoffwechsel nach sich zieht“, sagt Andreas Fischer vom Deutschen Krebsforschungszentrum in Heidelberg und von der Medizinischen Fakultät Mannheim der Universität Heidelberg. Während gesunde Herzen ihren Energiebedarf zu mehr als 75 Prozent aus Fettsäuren gewinnen, steigen geschwächte Herzen auf Kohlenhydrate als bevorzugte Energiequelle um. Doch der Zusammenhang gilt auch umgekehrt. In Zusammenarbeit mit weiteren Kollegen des Zentrums sowie des Universitätsklinikums Heidelberg hat Fischer jetzt festgestellt: Eine Umstellung des Stoffwechsels von Fettsäuren als Energiequelle zugunsten von Kohlenhydraten verursacht Herzinsuffizienz.
Als biochemischen Schlüssel zu diesem Effekt identifizierte das Team um Fischer ein Rezeptormolekül namens Notch-1. Mit Hilfe eines therapeutischen Antikörpers, der vorwiegend in Zellen der Blutgefäßwand wirkt, hatten die Wissenschaftler bei Mäusen den Notch-1-Signalweg blockiert. In der Folge entwickelten die Tiere eine Herzinsuffizienz. In einem weiteren Experiment nutzten die Forscher einen genetischen Trick und züchteten Mäuse, bei denen sich die Notch-1-Signalübertragung gezielt in den Endothelzellen, die die Blutgefäße von innen auskleiden, ausschalten lässt. Wieder erkrankten die Tiere innerhalb weniger Wochen an Herzinsuffizienz.
„Dieser deutliche Effekt hat uns selbst überrascht“, sagt Markus Jabs, Erstautor der Studie. Doch er hat auch eine Erklärung parat: „Damit Nährstoffe aus den Blutgefäßen in den Herzmuskel gelangen, müssen sie durch die Endothelzellen transportiert werden.“ Wir haben nun den Rezeptor Notch-1 als wichtige Kontrollinstanz für den Transport von Fettsäuren aus dem Blut ins Herzmuskelgewebe identifiziert. Wird Notch-1 blockiert, stehen dem Herzen weniger Fettsäuren zur Verfügung und es muss auf Zucker als Energiequelle umsteigen“, so Jabs. Dabei wird ein weiterer Signalweg namens mTOR-aktiviert, der zu einem Wachstum des Herzmuskels und schließlich zur Herzinsuffizienz führt. Ein Blockieren dieses Signalwegs konnte im Experiment verhindern, dass die Mäuse eine Herzinsuffizienz entwickelten. Denselben Effekt hatte eine extrem kohlenhydratarme Diät.
„Das bedeutet jedoch nicht, dass wir Kohlenhydrate vollständig vom Speiseplan streichen sollen, um Herzinsuffizienz zu verhindern“, sagt Fischer. Der Arzt und Wissenschaftler ist überzeugt, dass kohlenhydrathaltige Ernährung alleine keine Herzschwäche verursacht. „Unsere Ergebnisse zeigen aber, welche wichtige Bedeutung eine Veränderung des Stoffwechsels, etwa aufgrund von angeborenen oder erworbenen Stoffwechselerkrankungen, für den Verlauf einer Herzinsuffizienz hat.“ Möglicherweise hat das Forscherteam damit eine wichtige Stellschraube für die Therapie der Herzschwäche aufgezeigt.
Die Ergebnisse der DKFZ-Forscher haben darüber hinaus eine weitreichende Bedeutung für die Krebsforschung. Notch-1 erfüllt im Körper vielfältige Funktionen und stellt ein Onkogen dar. Mutationen, die zu einer verstärkten Aktivierung führen, können das Entstehen und die Entwicklung von Tumoren begünstigen.
Das macht den Notch-Signalweg zu einem interessanten Angriffspunkt für die Krebstherapie. Zumindest theoretisch: Denn bei einigen frühen klinischen Studien mit einem Wirkstoff, der diesen Signalweg blockiert, erkrankten Probanden an einer Herzinsuffizienz. „Unsere Ergebnisse können diese vermeintlich überraschende Nebenwirkung nun erklären“, sagt Fischer. „Solche Wirkstoffe sollten daher nur unter sehr engmaschiger kardiologischer Kontrolle eingesetzt werden.“ Möglicherweise könnten auch spezielle Diäten oder eine zusätzliche Blockade des mTOR-Signalwegs während der Behandlung helfen, die lebensbedrohliche Nebenwirkung Herzinsuffizienz zu verhindern, vermutet der Wissenschaftler.
Markus Jabs, Adam J. Rose, Lorenz H. Lehmann, Jacqueline Taylor, Iris Moll, Tjeerd P. Sijmonsma, Stefanie E. Herberich, Sven W. Sauer, Gernot Poschet, Giuseppina Federico, Carolin Mogler, Eva-Maria Weis, Hellmut G. Augustin, Minhong Yan, Norbert Gretz, Roland M. Schmid, Ralf H. Adams, Hermann-Joseph Gröne, Rüdiger Hell, Jürgen G. Okun, Johannes Backs, Peter P. Nawroth, Stephan Herzig, Andreas Fischer: Inhibition of endothelial Notch signaling impairs fatty acid transport and leads to metabolic and vascular remodeling of the adult heart. Circulation, 2018
DOI 10.1161/CIRCULATIONAHA.117.029733
Ein Bild zur Pressemitteilung steht zum Download zur Verfügung unter:
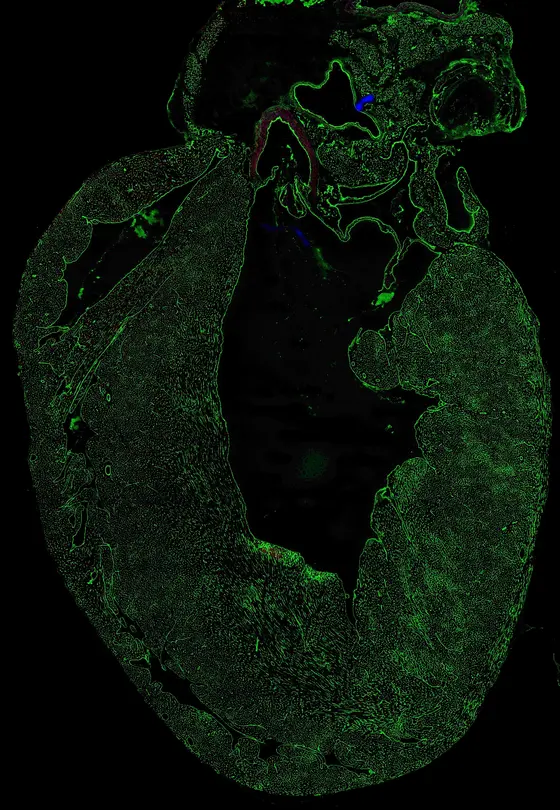
heart_cd31.jpg
BU: Schnitt durch das Herz einer Maus. Die Gefäße sind grün dargestellt.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: Iris Moll, DKFZ“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.