Um Zellen infizieren zu können, müssen Viren zunächst an spezielle Rezeptor-Eiweiße auf der Zelloberfläche binden. Das Hepatitis-B-Virus bindet mit einem Abschnitt seines “L-Proteins" in der Virushülle an Heparansulfalt-Proteoglykane (HSPG) auf Leberzellen. Daraufhin wird es in die Zelle aufgenommen und kann sich dort vermehren.
„Die Effizienz, mit der das Hepatitis-B-Virus Zellen infiziert, liegt mehrere Größenordnungen über der der meisten anderen Viren", sagt Stefan Seitz, Erstautor der Studie, der am Zentrum für Infektiologie, Molekulare Virologie, des Universitätsklinikums Heidelberg und am DKFZ arbeitet. In der Tat infiziert das Hepatitis-B-Virus hochspezifisch Leberzellen. Dies ist umso erstaunlicher angesichts der Tatsache, dass die HSPG-Moleküle, die dem Virus als Rezeptor dienen, quasi auf allen Zelltypen im menschlichen Körper vorkommen. „Für ein Virus, das ein Organ erreichen muss, das weit weg von der Eintrittspforte in den Körper liegt, scheint das HSPG der ungünstigste Rezeptor zu sein, den man sich vorstellen kann", fügt Seitz hinzu. Diesen Widerspruch wollten die Wissenschaftler aufklären.
Dabei halfen ihnen zwei kürzlich aufgedeckte Geheimnisse des Virus. Erstens zeigten neue elektronenmikroskopische Aufnahmen des Hepatitis-B-Virus, dass der Erreger in zwei verschiedenen Varianten vorkommt, die unterschiedlich aussehen. Zweitens kann das L-Protein in der Virushülle ebenfalls zwei verschiedene Formen annehmen. In einem Fall ist der Abschnitt, der an den Rezeptor auf der Leberzelle bindet, ins Innere des Viruspartikels gerichtet, im anderen Fall nach außen. Nur die nach außen gerichtete Form ermöglicht es dem Virus, Leberzellen zu infizieren.
Seitz und seine Kollegen hielten es für wahrscheinlich, dass ein Zusammenhang zwischen diesen beiden Beobachtungen besteht. Sie stellten die Hypothese auf, dass die Hepatitis-B-Viren ihre Gestalt verändern, während sie die Orientierung des L-Proteins wechseln. Um diese Hypothese zu überprüfen, etablierten sie einen biochemischen Test, mit dem sie die reife, an HSPG bindende Variante B von der unreifen Variante N, die nicht an HSPG binden kann, unterscheiden konnten. Die anschließende Analyse ergab, dass nahezu alle Viren die Zellen im unreifen Zustand (N) verlassen und sich dann spontan in die reife, bindende (B) Form verwandeln, indem sie den Rezeptor-bindenden Abschnitt des L-Proteins von innen nach außen stülpen.
Das Reifen der Viren vom N-Typ in den infektiösen B-Typ stellte sich als langsamer Prozess heraus. Nachdem die Wissenschaftler eine geringe Anzahl von Viren in Mäuse injiziert hatten, blieben die B-Typ-Viren zum großen Teil an anderen Geweben hängen. Die N-Typ-Viren erreichten dagegen in großer Zahl ihr Zielorgan, die Leber und konnten dort – nachdem sie sich in die B-Form umgewandelt hatten - die Leberzellen infizieren.
Dieser langsame Wandlungsprozess scheint die Effektivität der Hepatitis-Infektion zu erhöhen. Er erklärt auch, warum selbst geringe Virusmengen Leberzellen hochspezifisch infizieren, obwohl HSPG-Rezeptoren im Körper weit verbreitet sind. „In der unreifen N-Form sind die Viren inaktiv und können daher konstant mit dem Blutstrom mitschwimmen, bis sie die Leber erreichen, wo sie schließlich aufgehalten werden. Sobald sie hier in die reife B-Form wechseln, sind sie in der Lage, die Leberzellen zu infizieren.
Ralf Bartenschlager, der Letztautor der Studie, der sowohl im Zentrum für Infektiologie, Molekulare Virologie des Universitätsklinikums, als auch im DKFZ eine Forschungsabteilung leitet, fasst zusammen: „Das ist ein bisher unbekannter und sehr eleganter Mechanismus für einen viralen Reifungsprozess, der sich fundamental von allen bisher beschriebenen unterscheidet. Unsere Studie zeigt auch, dass Hepatitis-B-Viren keine starren unbeweglichen Objekte sind, sondern hochbewegliche Miniaturmaschinen mit einem präzise laufenden Uhrwerk. Eigentlich handelt es sich um kleine tickende Zeitbomben, die plötzlich molekulare Enterhaken herausschleudern, um ihre Zielzellen zu infizieren.“
Seitz und Bartenschlager gehen davon aus, dass der neu entdeckte Mechanismus einen neuen Angriffspunkt für Medikamente bietet. „Man könnte Substanzen entwickeln, die die Viren im unreifen, nicht-infektiösen Zustand blockieren. Solche Hemmstoffe könnten die Therapie der chronischen Hepatitis B unterstützen, die nach wie vor unheilbar ist und eine häufige Ursache für Leberkrebs darstellt“, sagt Stefan Seitz.
Die Gruppe um Seitz und Bartenschlager hat schon das nächste Ziel vor Augen: Sie möchten nun genau verstehen, wie der Reifungsprozess im molekularen Detail abläuft, wodurch er ausgelöst wird und wie man ihn hemmen kann. „Wenn wir es schaffen, die chronische Hepatitis-B-Virus Infektion zu unterbrechen und das Virus zu eliminieren, könnten wir das Krebsrisiko von Infizierten drastisch reduzieren“, sagt Bartenschlager.
Stefan Seitz, Caroline Iancu, Tassilo Volz, Walter Mier, Maura Dandri, Stephan Urban, Ralf Bartenschlager: „A Slow Maturation Process Renders Hepatitis B Virus Infectious“ in: Cell Host & Microbe, 16.6.2016. DOI: dx.doi.org/10.1016/j.chom.2016.05.013
Zwei Bilder zur Pressemitteilung stehen zur Verfügung unter:
SmilingHBV.jpg
Bildlegende: Hepatitis-B-Viren haben bald nichts mehr zu lachen: Elektronenmikroskopische Aufnahme von Hepatitis-B-Viren (große ovale Strukturen mit dunklem Kern) und nicht-infektiöse Virushüllen (kleine runde bzw. längliche Strukturen).
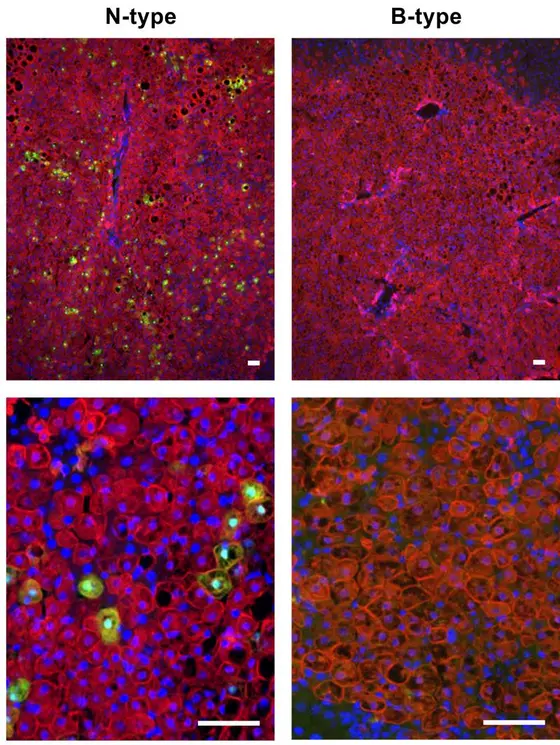
Immunhisto-HBV.jpg
Bildlegende: Immunhistochemie: Nur Hepatitisviren (grün) vom N-Typ (links) gelangen mit dem Blutstrom in die Leber und können dort Leberzellen (rot) infizieren, HBV vom B-Typ (rechts) gelingt dies nicht.
Quelle: Universitätsklinikum Heidelberg / S.Seitz