Biomarker spielen heute in der Krebsmedizin eine wichtige Rolle, um Krebserkrankungen präziser zu diagnostizieren und den Krankheitsverlauf besser vorherzusagen. Ein häufig mit Leukämie assoziierter Marker ist der Chromosomenfehler „Translokation 8;21“, wobei sich ein Stück des Chromosoms 8 mit dem Chromosom 21 verbindet. Bereits in den 1970er Jahren erkannte man, dass ein erheblicher Teil von Patienten, die an der Blutkrebsform Akuter Myeloischer Leukämie (AML) leiden, diese Chromosomenveränderung in den entarteten Krebszellen tragen. Wissenschaftliche Studien zeigten jedoch, dass der Chromosomenumbau allein nicht ausreicht, um Leukämie auszulösen.
Im Rahmen des Deutschen Konsortiums für Translationale Krebsforschung (DKTK) haben Forscher an der Medizinischen Klinik III des Klinikums der Universität München (LMU) jetzt eine neue Mutation entdeckt, die das Wachstum der Krebszellen begünstigt. Durch die Mutation im Gen „ZBTB7A“ wird der Energieumsatz der Zellen angekurbelt. „In gesunden Zellen wirkt das aktive ZBTB7A-Gen wie eine Handbremse für den Stoffwechsel“, erklärt Philipp Greif, der die DKTK Nachwuchsgruppe Pathogenese der Akuten Myeloischen Leukämie an der LMU leitet. „Ist das Gen defekt, erhalten die Krebszellen mehr Energie, um sich ungebremst zu teilen.“
Umgekehrt konnten die Wissenschaftler zeigen, dass sich das Wachstum von Leukämiezellen drosseln lässt, wenn die Krebszellen gentechnisch so verändert werden, dass sie vermehrt aktives ZBTB7A produzieren. Einen Hinweis auf den wachstumshemmenden Effekt des Gens beobachteten die Forscher auch in der Klinik: Leukämiepatienten, in deren Krebszellen das Gen vermehrt abgelesen wird, hatten eine deutlich höhere Überlebenschance, als solche, bei denen das ZBTB7A-Gen kaum oder gar nicht aktiv war.
Im DKTK gehört Philipp Greif zu den forschenden Ärzten, die nach neuen Ansätzen suchen, um Patienten zielgerichteter therapieren zu können. „Den Krankheitsverlauf anhand von genetischen Markern einzuschätzen hilft uns, die richtige Therapie zu empfehlen. In manchen Fällen besteht die Möglichkeit mit einer Chemotherapie allein zu heilen, während in anderen Fällen nur die anschließende Stammzelltransplantation eine Chance auf Heilung bietet“, betont Philipp Greif. Mithilfe des verfügbaren Probenmaterials im Labor für Leukämiediagnostik der LMU und der Sammlung der anderen DKTK Standorte wollen die Wissenschaftler herausfinden, ob sich der neue Marker dazu eignet, um Therapien individuell auf einzelne Patienten zuzuschneiden.
Auch für die Entwicklung neuer Therapieansätze für AML Patienten ist die Entdeckung vielversprechend. „Mit speziell veränderten Zuckermolekülen ließe sich der Energiegewinnungsprozess der AML Zellen möglicherweise blockieren“, erläutert die Erstautorin der Studie Luise Hartmann „Erste klinische Prüfungen bei anderen Krebserkrankungen haben bereits gezeigt, dass solche Wirkstoffe für Patienten gut verträglich sind.“
Rund ein Viertel der Leukämiepatienten mit der Chromosomenveränderung 8;21 tragen das mutierte ZBTB7A-Gen. Aber auch bei Leukämiepatienten, in deren Krebszellen keine Mutationen im ZBTB7A-Gen nachweisbar waren, sahen die Wissenschaftler einen deutlichen Zusammenhang zwischen der Aktivität des Gens und dem Krankheitsverlauf. „Die Therapie mit dem Stoffwechsel-Hemmer könnte daher bei einem größeren Kreis von Patienten funktionieren“, sagt Philipp Greif. Auch für andere Krebsarten könnte der Ansatz interessant werden. ZBTB7A-Mutationen kommen beispielsweise auch bei anderen Krebserkrankungen, wie z.B. beim Darmkrebs vor.
Hartmann, L. et. al.: ZBTB7A mutations in acute myeloid leukaemia with t(8;21) translocation. In: Nature Communications (02. Juni 2016) DOI: 10.1038/NCOMMS11733
Förderung: Dieses Projekt wurde durch die Wilhelm Sander-Stiftung (2014.162.1) und durch den SFB 1243 „Cancer Evolution“ (DFG) gefördert.
Ein Bild zu dieser Mitteilung steht im Internet zur Verfügung unter:
aml-zelle-klinikum-muenchen.jpg
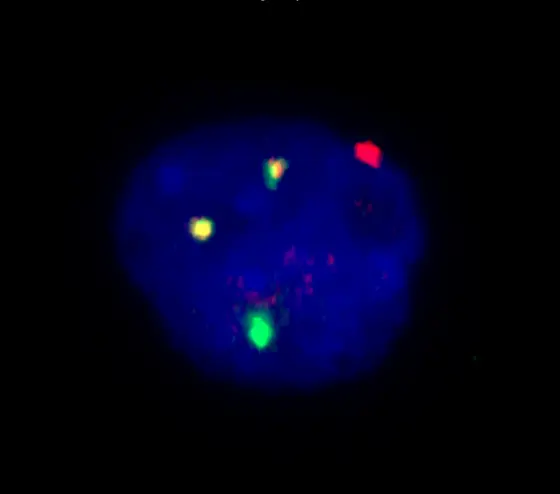
Bildlegende: Leukämiezelle mit dem Chromosomenfehler 8;21: Die beiden gelben Signale zeigen, wo sich jeweils ein Stück eines Chromosoms 8 (rot) mit einem Stück von Chromosom 21 (grün) verbunden hat.“
Quelle: Stephanie Schneider /Labor für Leukämiediagnostik, Klinikum der LMU