Patienten mit Bauchspeicheldrüsenkrebs (Pankreastumoren) sind mit einer schlechten Prognose konfrontiert: Oft bleiben ihnen nach der Diagnose nur noch wenige Monate Zeit. Das liegt meist daran, dass die Erkrankung häufig erst entdeckt wird, wenn der Tumor bereits metastasiert hat und zu diesem Zeitpunkt eine Operation nicht mehr sinnvoll ist. Außerdem sind viele der Tumoren resistent gegenüber Chemotherapien. Seit kurzem ist bekannt, dass es drei verschiedene Typen von Pankreastumoren gibt. Sie unterscheiden sich in ihrer Aggressivität, aber auch in ihrem Ansprechen auf Medikamente, wie ein Forscherteam um Andreas Trumpp und Martin Sprick vom DKFZ und vom Stammzell-Institut HI-STEM gGmbH, einer Partnerschaft des DKFZ und der Dietmar Hopp Stiftung, nun herausfand.
Die Forscher stellten fest, dass Zellen des resistenten Subtyps verstärkt das Enzym CYP3A5 produzieren, welches normalerweise in der Leber aktiv ist. „Die Pankreas-Tumorzellen machen sich diese Enzymkaskade zunutze und bauen damit Medikamente ab, bevor sie überhaupt wirken können“, berichtet die Erstautorin Elisa Noll. „So sind sie gegen viele derzeit verwendete Krebsmedikamente resistent.“ Martin Sprick ergänzt: „Es ist uns bereits gelungen, das Enzym in den Tumorzellen und sogar in tumortragenden Mäusen gezielt zu blockieren, und die Zellen dadurch für die Medikamente wieder empfindlich zu machen. Wir hoffen nun, Substanzen zu finden, die wir auch beim Patienten einsetzen können.“
Die CYP3A5-vermittelte Medikamentenresistenz kann bei Krebszellen auch erst im Laufe der Behandlung auftreten. „Circa zwanzig Prozent der Pankreastumoren sind durch die Produktion dieses Enzyms von vornherein resistent. Wir gehen aber davon aus, dass die sekundäre Resistenz bei noch wesentlich mehr Patienten eine Rolle spielt“, so Sprick. Der Grund für diese Annahme ist, dass bei längerer Gabe des Medikaments Paclitaxel zuvor sensitive Tumorzellen plötzlich vermehrt CYP3A5 produzierten und dann nicht mehr auf die Behandlung ansprachen.
Auch in anderen Tumoren, wie zum Beispiel dem Magenkarzinom oder Leberkrebs, fanden die Forscher Hinweise auf eine CYP3A5-vermittelte Medikamentenresistenz. Möglicherweise ist dieser bislang unbekannte Mechanismus auch Ursache für das Scheitern einzelner klinischer Studien. Das möchte die Forschergruppe nun in Zusammenarbeit mit dem Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg, einer gemeinsamen Einrichtung des DKFZ mit dem Universitätsklinikum Heidelberg, untersuchen.
Um heraus zu finden, ob ein Patient am primär resistenten Pankreaskarzinom erkrankt ist, haben die Wissenschaftler auch Marker für die Diagnostik entwickelt. In Zusammenarbeit mit dem Europäischen Pankreaszentrum und der Pathologie des Universitätsklinikums Heidelberg untersuchten sie den molekularen Aufbau einer großen Anzahl an Bauchspeicheldrüsentumoren. Die aus diesen Tumoren gezüchteten Zelllinien produzierten je nach Tumorsubtyp entweder das Protein KRT81 oder HNF1A, beziehungsweise keines der beiden. Diese Marker können die Wissenschaftler nun mittels Antikörper-Färbung schnell und zuverlässig in Patientenproben nachweisen.
Bisher ist eine Klassifizierung der Pankreastumoren in der Klinik schwierig umzusetzen, was dazu führt, dass die meisten Patienten die gleiche Behandlung erhalten. „Diese Marker ermöglichen es nun, verschiedene Typen von Bauchspeicheldrüsentumoren in der Routinediagnostik zu unterscheiden und möglicherweise die Behandlung entsprechend abzustimmen“, erläutert Andreas Trumpp. „Das Ziel ist Patienten durch die bessere Diagnostik eine erfolgreichere individualisierte Behandlung anbieten zu können.“
Diese Arbeiten wurden durch das Bundesministerium für Bildung und Forschung (BMBF) unterstützt.
Ein Bild zur Pressemitteilung steht im Internet zur Verfügung:
CUP3A.jpg
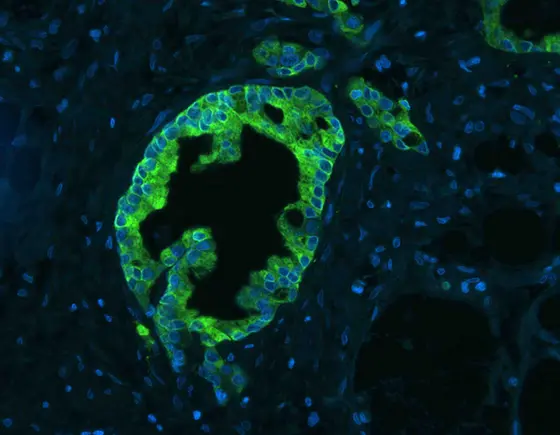
BU: Menschliche Bauchspeicheldrüsenkrebszellen. Zellkerne sind blau gefärbt. In Tumorzellen lässt sich das Enzym CYP3A5 nachweisen (grün), in gesunden Zellen ist es nicht vorhanden. Bild: Martin Sprick, DKFZ
Elisa M Noll, Christian Eisen, Albrecht Stenzinger, Elisa Espinet, Alexander Muckenhuber, Corinna Klein, Vanessa Vogel, Bernd Klaus, Wiebke Nadler, Christoph Rösli, Christian Lutz, Michael Kulke, Jan Engelhardt, Franziska M Zickgraf, Octavio Espinosa, Matthias Schlesner, Xiaoqi Jiang, Annette Kopp-Schneider, Peter Neuhaus, Marcus Bahra, Bruno V Sinn, Roland Eils, Nathalia A Giese, Thilo Hackert, Oliver Strobel, Jens Werner, Markus W Büchler, Wilko Weichert, Andreas Trumpp & Martin R Sprick: CYP3A5 mediates basal and acquired therapy resistance in different subtypes of pancreatic ductal adenocarcinoma, Nature Medicine 2016, doi:10.1038/nm.4038