Krebs-Impfungen sollen das körpereigene Immunsystem gezielt gegen Tumorzellen scharf machen. Als besonders erfolgsversprechend gelten Impfungen gegen so genannte Neo-Antigene: Dabei handelt es sich um Proteine, die sich aufgrund einer genetischen Mutation der Tumorzellen von ihren Gegenstücken in gesunden Zellen unterscheiden. Der kleine Unterschied – teilweise ist nur ein einziger Proteinbaustein ausgetauscht – verleiht dem Protein auf der Tumorzelle neuartige immunologische Eigenschaften, die von den T-Zellen des Abwehrsystems als „fremd“ erkannt werden können. Eine Impfung mit einem solchen Protein bzw. mit einem kurzen Protein-Abschnitt („Peptid“), der genau die mutierte Stelle umfasst, kann Immunzellen gezielt auf den Tumor lenken.
„Die grundlegende Voraussetzung für den Erfolg einer solchen Impfung ist aber, dass das Impfpeptid den Immunzellen auf der Oberfläche des Tumors präsentiert wird, und zwar genau passend zurechtgeschnitten. Ob das der Fall ist, kann unser neuer Test nachweisen“, erläutert Professor Michael Platten, Abteilungsleiter im Deutschen Krebsforschungszentrum und zugleich Leitender Oberarzt in der Neurologischen Klinik des Universitätsklinikums Heidelberg. Das Impfpeptid muss exakt in die „Präsentierteller“, die so genannten MHC-Moleküle, auf der Oberfläche der Tumorzellen passen, was nur bei entsprechender molekularer Ausstattung der Zelle gelingt. Immunzellen reagieren ausschließlich dann, wenn ihr Antigen auf den passenden MHC-Molekülen angeboten wird. Ansonsten kommt keine Abwehrreaktion zustande.
Auch wenn krebsspezifische Neo-Antigene in Tumorzellen vorhanden sind, heißt das noch nicht, dass sie tatsächlich auch von den MHC-Molekülen präsentiert werden können. Michael Platten, der selbst an einer Tumorimpfung arbeitet, sucht daher nach einem Testverfahren, um schon an der Biopsie des Tumors prüfen zu können, ob die MHC-Moleküle das Neo-Antigen auf der Tumorzelloberfläche präsentieren.
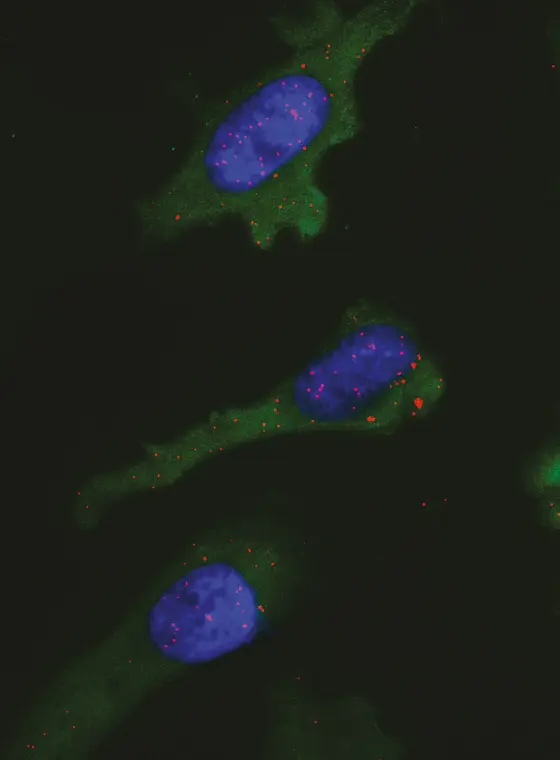
Mit seinen Kollegen beschreibt er nun eine trickreiche Lösung für dieses Problem: Das Prinzip des PLA-Tests* beruht auf zwei Antikörpern, von denen einer das Neo-Antigen, der andere das MHC-Molekül erkennt. Nur wenn die Zielstrukturen der beiden Antikörper in allernächster Nähe zueinander liegen, kommt es durch eine molekularbiologische Reaktion zu einem Leuchtsignal.
Am Paradebeispiel eines Tumor-Neoantigens demonstrierten die Forscher nun Leistungsfähigkeit des neuen Tests: Bestimmte Hirntumoren, die niedriggradigen Gliome, tragen in über 70 Prozent der Fälle einen identischen Schreibfehler im Erbgut. Der führt dazu, dass im Enzym Isocitrat-Dehydrogenase-1 (IDH1) ein einziger Eiweißbaustein an Position 132 des Proteins ausgetauscht wird.
Mit ihrem PLA-Test wiesen die Forscher an Gewebeproben von Gliomen nach, dass das IDH1-mutierte Peptid auf der Oberfläche der Krebszellen zusammen mit dem MHC-Molekül vorliegt.
Der Test funktionierte gleichermaßen erfolgreich für ein anderes Tumorantigen: Bei NY-ESO-1 handelt es sich nicht um ein mutationsinduziertes Neo-Antigen, sondern es zählt zu den körpereigenen Proteinen, das normalerweise nur bei bestimmten Entwicklungsschritten eine Rolle spielen und von vielen Krebszellen „außer der Reihe“ produziert werden. NY-ESO-1 kommt bei vielen Krebsarten vor. Mit dem PLA-Test konnten die Forscher es auf Melanomzellen in Verbindung mit den MHC-Molekülen nachweisen.
In zahlreichen klinischen Studien werden weltweit vielversprechende Impfungen und zielgerichtete Immuntherapien erprobt, etwa gegen schwarzen Hautkrebs, Nierenzellkrebs oder Lungenkrebs „Unser Test könnte dazu beitragen, vorab diejenigen Patienten zu identifizieren, die tatsächlich von einer solchen Impfung profitieren können“, sagt Lukas Bunse, einer der Erstautoren der Studie und schränkt ein: „Die Voraussetzung ist allerdings, dass es einen spezifischen Antikörper gegen das Tumorantigen gibt.“
Nachdem Michael Platten und seine Kollegen kürzlich zeigen konnten, dass das mutierte IDH1-Peptid gezielte Immunantworten gegen Hirntumoren auslöst, wollen sie in Kürze eine klinische Studie der Phase I starten, um die Sicherheit des Peptid-Impfstoffs gegen IDH1-mutierte Gliome zu überprüfen.
*PLA = Proximity Ligation Assay
Lukas Bunse, Theresa Schumacher, Felix Sahm, Stefan Pusch, Iris Oezen, Katharina Rauschenbach, Marina Gonzalez, Gergely Solecki, Matthias Osswald, David Capper, Benedikt Wiestler, Frank Winkler, Christel Herold-Mende, Andreas von Deimling, Wolfgang Wick und Michael Platten: Proximity ligation assay evaluates IDH1R132H presentation in gliomas. The Journal of Clinical Investigation 2015, DOI: 10.1172/JCI77780
Ein Bild zur Pressemitteilung ist im Internet verfügbar unter
PLA_Cover.jpg
Legende: Eine Tumorzelle präsentiert das Krebs-Antigen auf ihrer Oberfläche: Die roten Punkte zeigen an, wo MHC-Moleküle das Tumorantigen gebunden haben.
Quelle: M. Platten/DKFZ