Biomedizinische Physik in der Radioonkologie
- Bildgebung und Radioonkologie

Prof. Dr. Joao Seco
Head of Division of Biomedical Physics in Radiation Oncology
Radiotherapy (RT) plays a key role in the treatment of numerous solid tumors. It involves the precise targeting of high-energy X-ray, electrons or particle beams to localized tumors. Our department focuses on developing new technologies to maximize the benefits of RT. New technologies include physical, medical and biological innovations in radiotherapy, such as the development of FLASH-RT and spatially fractionated RT (SFRT).

Unsere Forschung
Aktuelle Forschungsprioritäten
Die Ultra-High-Dose-Rate-Strahlentherapie (UHDR) oder FLASH-RT ist eine neuartige Technologie, bei der eine ultraschnelle Strahlentherapie mit Dosisraten durchgeführt wird, die um mehrere Größenordnungen höher sind als bei der herkömmlichen Strahlentherapie (CONV) in der klinischen Praxis (FLASH>=40Gy/s und CONV~0,1Gy/s). Die FLASH-Strahlentherapie zeigt eine bemerkenswerte Schonung des normalen Gewebes bei ähnlicher Anti-Tumor-Wirksamkeit, die als FLASH-Effekt“ bezeichnet wird. Der molekulare Mechanismus, der dem FLASH-Effekt zugrunde liegt, ist noch unbekannt.
Die derzeitigen Forschungsinteressen der Abteilung sind: 1) Untersuchung des Mechanismus hinter dem FLASH-Effekt und der SFRT, 2) Untersuchung des Mechanismus der durch Strahlung ausgelösten DNA-Schäden durch reaktive Sauerstoffspezies (ROS), 3) Entwicklung neuartiger Bildgebungstechnologien zur Verringerung der „Messunsicherheiten“ bei der Positionierung des Bragg-Peaks für die Ionenstrahl-Strahlentherapie unter Verwendung von Heliumstrahl-Bildgebung und zeitnaher Gammaspektroskopie.
Aktuelle Entwicklungen
Untersuchung der Hypothese der Sauerstoffverarmung während der FLASH-RT-Bestrahlung.
Wir haben durch direkte Messung des Sauerstoffverbrauchs während der Bestrahlung nachgewiesen, dass bei FLASH-Raten (Jansen 2021 [1]) keine Sauerstoffverarmung auftritt. Es zeigte sich, dass der Sauerstoffverbrauch bei hohen Dosisleistungen geringer ist, was der Sauerstoffverarmungshypothese widerspricht.
Bewertung der Dosisleistungsabhängigkeit des FLASH-Effekts
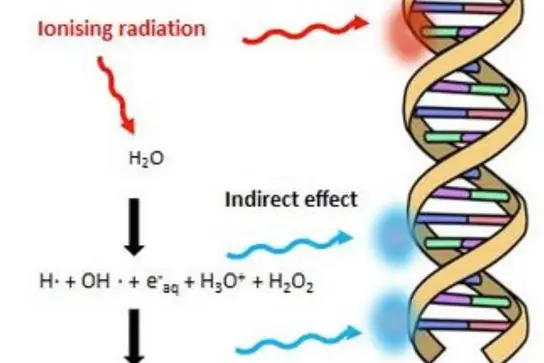
In einer Folgestudie, die im Medical Physics Journal (Zhang 2024 [2]) veröffentlicht wurde, konnten wir zeigen, dass die Dosisleistungsabhängigkeit des FLASH-Effekts mit der Rivalität zwischen dem solvatisierten Elektron (eaq) und dem Hydroxylradikal (OH) zusammenhängt. Die derzeitige Forschung konzentriert sich auf das Verständnis des Mechanismus, durch den FLASH gesunde Zellen vor Strahlungseffekten schützt
Untersuchung des Mechanismus, durch den die räumlich fraktionierte Strahlentherapie (SFRT) eine hohe Tumorkontrolle erreicht.
Wir stellen die These auf, dass Wasserstoffperoxid (H2O2) eine indirekte Schätzung der Wirksamkeit der SFRT liefern könnte (Dal Bello 2020 [3], Zhang 2023 [4]). Künftige Tierstudien sollen die Rolle von H2O2 bei der SFRT weiter untersuchen.
Methoden und Technologien
BONEOSCOPY-Technologie in der Partikeltherapie
Im Rahmen des Förderprogramms Pathfinder Open des Europäischen Innovationsrats (EIC) wird eine neuartige Technologie für die spektroskopische In-vivo-Analyse von Gewebe während der Partikelstrahltherapie entwickelt. Metastasierender Knochenkrebs ist eine unheilbare Krankheit und eine der am schwierigsten zu behandelnden Krebsarten. Aufgrund der hohen Dosis wird die Tumorbildgebung derzeit zu Beginn und am Ende der Standard-Partikelstrahlentherapie (PRT) durchgeführt, was eine personalisierte Behandlung erschwert. Das Hauptziel des Projekts Pathfinder Open: BoneOscopy ist die Entwicklung einer grundlegend neuen Technologie, die durch die tägliche Überwachung von Knochenkrebs während der PRT fundierte medizinische Entscheidungen ermöglicht. (https://accelopment.com/projects/boneoscopy/)
IFIGENIA-Technologie in der Nuklearmedizin und molekularen Bildgebung
Nuklearmedizin und molekulare Bildgebung werden in großem Umfang zur Diagnose und Behandlung einer Vielzahl von Krankheiten eingesetzt, darunter Krebs, Herz-Kreislauf-Erkrankungen und Hirnerkrankungen wie Alzheimer und Parkinson. Die Zahl der nuklearmedizinischen Verfahren in Europa ist jedoch deutlich geringer, da den meisten europäischen Ländern die für die Herstellung der Radioisotope erforderliche Spezialausrüstung fehlt. Im Rahmen der Horizon European Research Executive Agency (REA) wurde der Aufbau eines Exzellenzzentrums (Excellence Hub) in Südosteuropa (Griechenland, Slowenien, Bosnien und Herzegowina und Zypern) gefördert, um einen neuartigen Beschleuniger zu entwickeln, der eine Produktionsplattform für ein breites Spektrum von Radioisotopen sichern soll, in Kooperation mit DKFZ (Seco and Benesova Labs), CERN (Papaphilippou Lab) und GSI. Ein LINear ACcelerator (LINAC) bietet eine kompakte, kostengünstige und umweltfreundliche Option, die in unmittelbarer Nähe von Krankenhäusern aufgestellt werden kann. Dank der genauen Abstimmbarkeit von LINACs können Energieniveaus, Ströme und Ziele angepasst werden, was die Herstellung einer breiten Palette von Radioisotopen ermöglicht. Eine ähnliche Anlage mit der Bezeichnung NUSANO[5]wird derzeit in West Valley City, Utah, USA, gebaut und soll 2025 in Betrieb genommen werden. Das neuartige Center of Excellence trägt den Namen „IFIGENIA“.

Biomedizinische Physik in der Radioonkologie - Gruppenbild
FLASH 2024 Workshop Gruppenbild
FLASH Workshop 2025
Team
Kurzer Beschreibungstext zur Vorstellung der Teammitglieder.
- Profil anzeigen

Prof. Dr. Joao Seco
Head of Division of Biomedical Physics in Radiation Oncology
- Profil anzeigen
Lisa Alborghetti
PhD Student
- Profil anzeigen

Mark Arndt
PhD Student
- Profil anzeigen

Mariana Bras
PhD student
-
Viktoriia Bulanova
- Profil anzeigen

Sandra Casula
Administrative Assistant for Divisions E041, E270 and E280
- Profil anzeigen
Helena Dilling
Bachelor Student
-
Ruirui Dong
- Profil anzeigen
Diogo Engrácia
PhD Student
- Profil anzeigen

Rafael Espinhosa Cepeda Lopes
Master Student
- Profil anzeigen

Dr. Daniel Garcia
Postdoctoral Fellow
- Profil anzeigen
Cátia Filipa Gouveia Rosa
PhD Student
- Profil anzeigen

Niklas Jung
Bachelor Student
-
Dr. Clarence King
- Profil anzeigen
Konstantinos Koritsidis
Master Student
- Profil anzeigen
Simon Kubillus
Bachelor Student
- Profil anzeigen
Patrick Kudis
Master Student
-
Pinelopi Violeta Ladopoulou
- Profil anzeigen
Frau Joana Leitao
PhD Student
- Profil anzeigen
Art Lindner
Bachelor Student
- Profil anzeigen

Dr. Styliani Logotheti
Postdoctoral Fellow
- Profil anzeigen
Piet Meiners
Bachelor Student
- Profil anzeigen

Hugo Filipe Meles Freitas
Postdoctoral Fellow
-
Alba Meneses Felipe
- Profil anzeigen
Ömer Nuhoglu
Master Student
- Profil anzeigen

Joao Pedro Oliveira Lourenco
PhD Student
- Profil anzeigen

Dr. Francesca Pagliari
Deputy Head of Division of Biomedical Physics in Radiation Oncology
- Profil anzeigen

Dr. Alexander Pryanichnikov
Postdoctoral Fellow
-
Sandra Raquel Quitério Carreira
- Profil anzeigen
Kurt Schnepp
Bachelor Student
- Profil anzeigen

Mats Stauske
Master Student
- Profil anzeigen

Elpida Theodoridou
PhD Student
Projekte
BONEOSCOPY: Novel In-vivo Spectroscopy Analysis Technology for Particle Therapy
A novel technology for in vivo spectroscopic analysis of tissue during particle beam therapy is being developed as part of the European Innovation Council's (EIC) Pathfinder Open funding program. Metastatic bone cancer is an incurable disease and one of the most complex cancers to treat. Due to the high dose, tumor imaging is currently performed at the beginning and end of standard particle radiation therapy (PRT), making personalized treatment difficult. The primary goal of the Pathfinder Open: BoneOscopy project is to develop a radically new technology to enable informed medical decisions by monitoring bone cancer on a daily basis during PRT. (https://accelopment.com/projects/boneoscopy/)
IFIGENIA: New Linac for Nuclear Medicine and Molecular Imaging
Nuclear medicine and molecular imaging are widely used to diagnose and treat a wide range of diseases, including cancer, cardiovascular disease and brain disorders such as Alzheimer's and Parkinson's disease. However, the number of nuclear medicine procedures in Europe is significantly lower because most European countries lack the specialized equipment needed to produce the radioisotopes. Within the framework of the Horizon European Research Executive Agency (REA), funding has been received to develop a center of excellence (Excellence Hub) in South Eastern Europe (Greece, Slovenia, Bosnia and Herzegovina and Cyprus) to develop a novel accelerator dedicated to securing a production platform for a wide range of radioisotopes. A LINear ACcelerator (LINAC) provides a compact, cost-effective and environmentally friendly option that can be located in close proximity to hospitals. The tunability of LINACs allows energy levels, currents and targets to be adjusted, enabling the production of a wide range of radioisotopes. In particular, a similar facility, called NUSANO[5], is being built in West Valley City, Utah, USA, and will be operational in 2025. The novel center of excellence is called "IFIGENIA".
FLASH Zebra: Investigation of Oxygen Depletion Hypothesis
The project focuses on achieving a scientific breakthrough in determining the role of oxygen at the FLASH effect. It is well known that irradiation with high dose rates (>40 Gy/s) causes a protective effect of healthy tissue while maintaining tumor control (FLASH effect). However, the mechanisms contributing to this effect are yet to be understood. Starting from the oxygen partial pressure (pO2), a critical parameter for the prevalence of the FLASH effect, this project aims to design in-vivo oxygen measurements during conventional and FLASH radiation treatment and thus to correlate oxygen distribution and depletion with biological endpoints in zebrafish embryos (ZFE).
PROMPT FLASH: Developing real-time dosimetry for in-vivo assessment during FLASH
FLASH radiotherapy demonstrates a striking biological sparing effect of normal tissues while keeping similar anti-tumor efficacy, termed the “FLASH effect”. The measurement of dose at ultra-high-dose-rates or FLASH rates is complex as dosimeters may be susceptible to saturation at ultra-high dose rates. An in-vivo method of verifying the delivered FLASH dose is currently not available. It is vital to guarantee the accuracy of the delivered dose during FLASH. The current proposal focuses on a new method for verifying delivered FLASH dose in-vivo using prompt gamma x-ray spectroscopic (PGXS) analysis of irradiated tissue, which uses Gadolinium-Based Contrast Agents (GBCA) to amplify gamma/X-ray emission. A graphite calorimetry methodology will be used as absolute dose reference.
gROS MC-FLASH: Developing novel Monte Carlo tool for FLASH
The application of ultra-high dose rates (>40 Gy/s) or FLASH radiotherapy (FLASH-RT) has gained significant interest during the last years, when compared to conv-RT (given at 2 Gy/min) due to more than 50% reduction in toxicity in healthy lung tissue of mice. Despite extensive development of the Monte Carlo (MC) codes to
FLASH-RT, the codes struggle to model accurately the chemical impact of the different pulse structures. The Monte Carlo codes have not been capable of explaining why the H2O2 yield is lower in FLASH beams relative to conv-RT beams in pure water. The goal of the project is to develop and customize gROS, a new MC tool capable of simulating the production and diffusion of ROS for various dose-rate and pulse structure deliveries of radiation dose. The gROS MC tool
will be validated via measurements done in water (H2O) of ROS, H2O2 and O2 consumption, for the various pulse structures and dose rates. The gROS Monte Carlo will be tested at the Marburg Ion-Beam Therapy Center (MIT) facility for various cell types (cancer and healthy) and for particles: electrons, protons and carbon ions. The key objectives are (1) To develop a gROS Monte Carlo tool capable of simulating production and diffusion of ROS and H2O2 for various low
(conv-RT) and ultra-high dose rate (FLASHRT) deliveries, for different pulse structures and at different oxygen concentrations within the medium; (2) To validate the gROS Monte Carlo tool based on measurements in H2O of O2 consumption and H2O2 (ROS) production for various pulse structures and at different oxygen concentrations within the medium; (3) To assess gROS estimate of ROS (H2O2) and O2 consumption by the radiation in an in-vitro 2D model of cancer and healthy cells irradiated with electrons, protons and carbon ions.
PrecisionXray (PXI) FLASH Shutter: Development of a table-top FLASH shutter system
A novel shutter is being developed jointly with PrecisionXray Inc, for allowing table-top FLASH conditions for Xray beams.
HELIOS: Development of Novel Particle Imaging Device for mixed He-C beam Imaging
Development of a novel range guided radiotherapy (RGRT) prototype to reduce toxicity in carbon ion therapy of non-small cell lung carcinoma (NSCLC), by invivo monitoring of the delivered dose to a moving tumor. The RGRT approach is based on a carbon beam with mixed-in helium ions, resulting in helium ions exiting the patient due to their longer range at same energy per nucleon. The exiting helium ions will allow for in-vivo and real-time monitoring of the carbon Bragg peak within the patient with 2mm accuracy, reducing the amount of healthy tissue that is irradiated. This will reduce patient toxicity and allow for improved tumor control.
Ausgewählte Publikationen
Jansen J, Knoll J, Beyreuther E, Pawelke J, Skuza R, Hanley R, Brons S, Pagliari F, Seco J.
Zhang T, Stengl C, Derksen L, Palskis K, Koritsidis K, Zink K, Adeberg S, Major G, Weishaar D, Theiß U, Jin J, Spadea MF, Theodoridou E, Hesser J, Baumann KS, Seco J.
Dal Bello R, Becher T, Fuss MC, Krämer M, Seco J
Zhang T, García-Calderón D, Molina-Hernández M, Leitão J, Hesser J, Seco J.
Heidelberger Institut für Radioonkologie (HIRO)
Unsere Abteilung ist Teil des Heidelberger Instituts für Radioongologie (HIRO).

Kontaktieren Sie uns

