Proteine oder Eiweißmoleküle bestehen aus langen Ketten aufeinanderfolgender Aminosäuren. Um ihre oft lebenswichtigen Funktionen ausüben zu können, muss jede Aminosäurekette eine bestimmte dreidimensionale Struktur einnehmen, sie muss sich falten. Ändern sich die Wachstumsbedingungen, steigt zum Beispiel die Umgebungstemperatur, kann es passieren, dass die Proteine ihre Struktur verlieren und sich entfalten. Dabei besteht die Gefahr, dass die entfalteten Proteinketten miteinander verklumpen. „Diese verklumpten Proteine können ihre Aufgabe natürlich nicht mehr erfüllen“, erklärt Prof. Dr. Bernd Bukau, der eine Brückenabteilung zwischen dem Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH) und dem Deutschen Krebsforschungszentrum (DKFZ) leitet. „Dieser Funktionsverlust kann zum Zelltod führen, etwa bei neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson oder auch bei Alterungsvorgängen.“
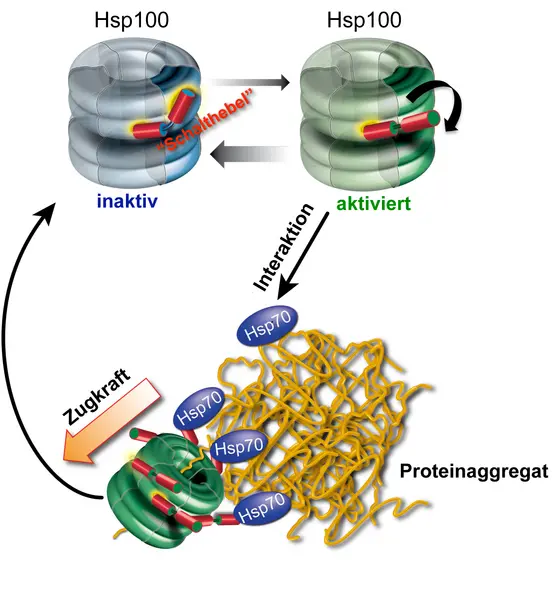
Eine Verklumpung muss jedoch nicht unbedingt den Endpunkt im Lebenszyklus eines Proteins darstellen. „Zellen besitzen Reparatursysteme, sogenannte molekulare Chaperone, die sogar verklumpte Proteine auflösen und zurückfalten können“, erläutert Privatdozent Dr. Axel Mogk, der ebenfalls dem ZMBH und dem DKFZ angehört. Die „Reparatur“ wird von einem Team von zwei Chaperonen – der französische Ausdruck für „Anstandsdame“ – mit den Bezeichnungen Hsp70 und Hsp100 durchgeführt. Die Heidelberger Wissenschaftler konnten nun zeigen, dass das HSP 70 über einen eingebauten molekularen Schalter die Aktivität des Hsp100-Chaperons regelt.
Dieser Schalter steht zunächst auf „aus“, das heißt, er drosselt den Energieverbrauch und damit die Aktivität des Hsp100-Chaperons. Sobald der Team-Partner, das Hsp70-Protein, ein verklumptes Protein entdeckt hat, stellt es den Schalter auf „an“ und aktiviert damit das Hsp100 direkt vor Ort. In diesem Zustand springt der „Motor“ des ringförmigen Hsp100-Proteins an und kann einzelne Aminosäureketten aus dem Proteinaggregat herausziehen. Das herausgelöste, entfaltete Protein hat danach wieder die Chance, seine ursprüngliche Gestalt einzunehmen und damit auch seine Funktion wieder auszuüben. Darüber hinaus konnten die Heidelberger Wissenschaftler zeigen, dass der eingebaute Schalter von essentieller Bedeutung für dieses komplizierte Reparatursystem ist, da dessen Verlust in dauerhaft aktiven Hsp100-Varianten zum Zelltod führt.
Die Forschungsarbeiten sind Teil der DKFZ-ZMBH-Allianz, der strategischen Zusammenarbeit des Deutschen Krebsforschungszentrums und des Zentrums für Molekulare Biologie der Universität Heidelberg. Am Heidelberger Institut für Theoretische Studien (HITS) werden neue theoretische Ansätze zur Interpretation der rasch wachsenden Menge experimenteller Daten entwickelt.
Originalveröffentlichungen:
F. Seyffer, E. Kummer, Y. Oguchi, J. Winkler, M. Kumar, R. Zahn, V. Sourjik, B. Bukau & A. Mogk: Hsp70 proteins bind Hsp100 regulatory M domains to activate AAA+ disaggregase at aggregate surfaces, Nature Structural & Molecular Biology, 18 November 2012, doi: 10.1038/nsmb.2442
Y. Oguchi, E. Kummer, F. Seyffer, M. Berynskyy, B. Anstett, R. Zahn, R.C. Wade, A. Mogk & B. Bukau: A tightly regulated molecular toggle controls AAA+ disaggregase, Nature Structural & Molecular Biology, 18 November 2012, doi: 10.1038/nsmb.2441