Der Hinweis kommt von Labormäusen auf „Junk Food“
Um das Immunsystem bei NASH zu untersuchen, fütterten die Wissenschaftler Labormäuse mit einer Diät, der es an essentiellen Nährstoffen mangelte, die aber mit Fett und Cholesterin angereichert war – vergleichbar unserem „Junk Food“ – und beobachteten die Entwicklung von NASH. Dabei untersuchten sie die Leber-Immunzellen per Einzelzell-RNA-Sequenzierung und fanden heraus, dass sich bei NASH ein bestimmter Zelltyp, die sogenannten dendritischen Zellen vom Typ 1 (oder cDC1), in außergewöhnlich hoher Zahl in der Leber ansammelt.
Dabei handelt es sich nicht um ein reines Maus-Phänomen. Auch in Gewebeproben, die Patienten bei Leberbiopsien entnommen wurden, fanden die Forscher: Je höher die Anzahl der cDC1, desto stärker ausgeprägt waren die NASH-typischen Leberschäden.
Haben die cDC1 tatsächlich einen Effekt auf die Leberpathologie? Dazu analysierten die Forscher auf zwei Wegen. Sie untersuchten Mäuse, die genetisch so verändert waren, dass ihnen cDC1 fehlen. Außerdem blockierten sie cDC1 in der Leber durch spezifische Antikörper. In beiden Versuchsansätzen war niedrigere Aktivität der cDC1 mit einer Linderung der Leberschäden verbunden.
Normalerweise überleben dendritische Zellen nur wenige Tage und müssen laufend vom Immunsystem ersetzt werden. Die Forscher entdeckten nun, dass die NASH-bedingten Gewebeschäden das blutbildende System im Knochenmark modulieren, so dass sich die Vorläufer der cDC1 häufiger teilen und mehr Nachschub bilden.
Dendritische Zellen induzieren aggressives Verhalten von T-Zellen
Bei einer normalen Immunreaktion suchen dendritische Zellen die Organe nach immunologischen Auffälligkeiten ab und wandern dann zu den benachbarten Lymphknoten, den Kommandozentralen der Immunreaktion, um diese Informationen an die T-Zellen weiterzuleiten. Das deutsch-israelische Team entdeckte nun, dass die cDC1 bei einer NASH in den für die Leber zuständigen Lymphknoten T-Zellen zu entzündlichem und aggressiveren Verhalten anstiften, das Leberschäden verursacht und die Erkrankung verschlimmert. „Diese autoaggressiven T-Zellen konnten wir erst vor kurzem als verantwortlich für die Leberschädigung bei einer NASH identifizieren – nun überblicken wir auch, wer sie zu diesem schädlichen Verhalten antreibt“, sagt Mathias Heikenwälder.
Nachdem sich die cDC1 als wichtiger Akteur beim Voranschreiten der NASH herausgestellt haben, könnte eine gezielte Manipulation dieser Zellen einen neuen Weg darstellen, die Leberentzündung und ihre schwerwiegenden Folgen zu behandeln. „Wir erkennen immer besser, dass bestimmte Zellen des Immunsystems an der Entstehung verschiedener Krankheiten beteiligt sind, darunter Krebs, Fettleibigkeit, Diabetes oder Alzheimer. Die Medizin verfolgt daher zunehmend Ansätze, das Immunsystem zu modulieren und mit Wirkstoffen in eine gewünschte Richtung zu lenken. Ein solcher Ansatz könnte auch funktionieren, um bei NASH-Patienten schwere Leberschäden zu vermeiden“, erklärt Heikenwälder.
Eran Elinav, ebenfalls Letztautor der Studie, der Forschungsgruppen am DKFZ und am Weizmann Institut leitet, hält es für sehr wahrscheinlich, dass auch die Bakterien des Darms die Immunzellen in dieser Erkrankung beeinflussen: „Wir wollen nun herausfinden, wie der Darm bzw. seine bakteriellen Bewohner die Aktivierung der Immunzellen in der Leber beeinflusst. So hoffen wir, neue Behandlungsstrategien entwickeln zu können.“
Warum Tierversuche in der Krebsforschung unverzichtbar sind
Leberkrebs ist das Paradebeispiel für eine durch chronische Entzündungen ausgelöste Krebserkrankung. Bis vor wenigen Jahren wiesen epidemiologische Untersuchungen chronische Infektion mit Hepatitisviren als Haupttreiber der Erkrankung aus. Doch in den letzten Jahren ist der Anteil der stoffwechselbedingten Tumoren stetig gestiegen. Forscher suchen daher dringend nach Wegen, diese verhängnisvolle Kaskade der Adipositas-bedingten Krebsentstehung besser zu verstehen, um therapeutisch – oder besser noch präventiv – eingreifen zu können. Für diese Untersuchungen müssen sie herausfinden, wie die Adipositas, die sich systemisch auf den gesamten Organismus auswirkt, in die Stoffwechselvorgänge und Immunreaktionen in der Leber eingreift. Dieses komplexes Geschehen lässt sich nicht in der Kulturschale nachstellen, sondern erfordert die Beobachtungen des gesamten Organismus. Untersuchungen an Mäusen sind besonders geeignet, da vergleichsweise einfach einzelne molekulare Treiber des Entzündungsvorgangs genetisch beeinflusst und damit ihre genaue Rolle identifiziert werden kann.
Aleksandra Deczkowska, Eyal David, Pierluigi Ramadori, Dominik Pfister, Michal Safran, Baoguo Li, Amir Giladi, Diego Adhemar Jaitin, Oren Barboy, Merav Cohen, Ido Yofe, Chamutal Gur, Shir Shlomi-Loubato, Sandrine Henri, Yousuf Suhail, Mengjie Qiu, Shing Kam, Hila Hermon, Eylon Lahat, Gil Ben-Yakov, Oranit Cohen-Ezra, Yana Davidov, Mariya Likhter, David Goitein, Susanne Roth, Achim Weber, Bernard Malissen, Assaf Weiner, Ziv Ben-Ari, Mathias Heikenwälder*, Eran Elinav*, Ido Amit*: XCR1+ type 1 conventional dendritic cells drive liver pathology in Non-Alcoholic Steatohepatitis
Nature Medicine 2021, DOI: https://www.nature.com/articles/s41591-021-01344-3
Ein Bild steht zum Download zur Verfügung unter: NASH-cDCs-40X.jpg
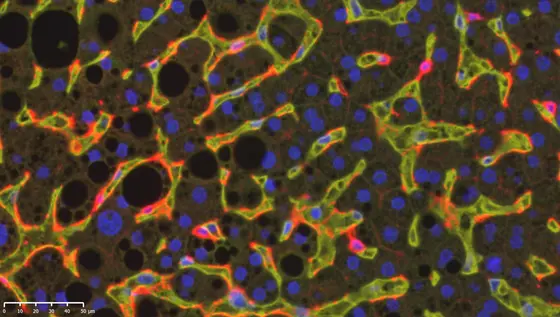
BU: Immunfluoreszenzaufnahme einer menschlichen NASH-Leber: Die rot gefärbten DC1-Zellen patrouillieren durch die erweiterten Leberkapillaren (gelb). Fetttröpfchen sind als schwarze Kreise zu erkennen.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: Heikenwälder / DKFZ“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.