Translationale Radiotheranostik
- Bildgebung und Radioonkologie
- Nachwuchsgruppe

Dr. Martina Benesova-Schäfer
Group Head
Im 21. Jahrhundert wird Krebs weiterhin eine führende Todesursache weltweit darstellen. Unsere Mission ist es, dem entgegenzuwirken – durch die vielversprechende Kombination aus personalisierter Radiodiagnostik und gezielter Radionuklidtherapie, bekannt als Radiotheranostik.

Was treibt uns an ?
Im Kern unserer Forschung steht die zielgerichtete Radionuklid-Therapie (TRNT), eine innovative Methode zur Krebsbekämpfung. Bei TRNT werden Radionuklide mittels selektiver Bindungsmotive an spezifische Tumor-Zielstrukturen wie Rezeptoren, Antigene oder Enzyme transportiert. Im Vergleich zur konventionellen externen Strahlentherapie (EBRT) bietet TRNT ein enormes Potential für die Behandlung metastasierender Tumoren und steht aktuell im Fokus neuer, vielversprechender Kombinationstherapien.
Abseits dieser Methode, untersuchen wir auch die zielgerichtete Alpha-Therapie (TAT), die in der Nuklearmedizin ein großes Interesse genießt. TAT nutzt Alphapartikel, die sich durch entscheidende Eigenschaften auszeichnen:
- Ein hoher linearer Energietransfer (LET; 50–230 keV/µm), der eine gesteigerte relative biologische Wirksamkeit im Vergleich zu anderen etablierten Radionuklid-Therapien ermöglicht.
- Geringere Eindringtiefen in das Gewebe von 50–100 µm (ca. sechs Zellschichten), was den Schaden am gesundem Gewebe in Tumornähe minimieren kann.
Die Rolle des Immunsystems in der Tumorentwicklung und -metastierung ist kritisch und nicht zu vernachlässigen. Infolgedessen ist die Kombination von TAT mit immuntherapeutischen Ansätzen besonders lukrativ um synergistische Effekte und verbesserte Behandlungseffizienzen zu erzielen.
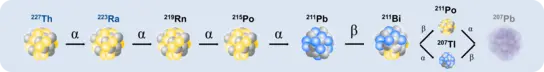
In hochinnovativen und interdisziplinären Projekten liegt unser aktueller Fokus auf Alphapartikel-emittierenden Radionukliden, wie Th-227, Ac-225 und Ra-223. Wir untersuchen deren Koordinationseigenschaften, physikochemische Effekte und strahlungsinduzierte Immunantworten im Tumorgewebe und der Mikroumgebung.
Mit diesem Wissen identifizieren wir neue therapeutische Angriffsziele und synthetisieren wirksame Radioliganden/Radiopharmazeutika für Zwecke der bildgebenden Diagnostik, Endoradiotherapie und intra-operative Chirurgie, um unsere vielversprechenden Erkenntnisse schnellstmöglich für eine verbesserte personalisierte Präzisionsmedizin in der Onkologie einzusetzen.
Woran arbeiten wir aktuell ?
Radionuklidseparation und -aufreinigung
Wir entwickeln effiziente Methoden zur Separation und Aufreinigung von α-Emittern, um deren Nutzung in der präklinischen Forschung und Klinik zu erweitern. Diese Strategien ermöglichen eine effektive Trennung ohne aufwendige Folgeschritte, eine bessere Verfügbarkeit der α-Emitter und sind auf weitere klinisch relevante Radionuklide übertragbar.
Radionuklidgeneratoren
Mit neuartigen Prototypen von Radionuklidgeneratoren wollen wir die (de-)zentralen Produktion von α-Emittern ohne notwendige Beschleuniger oder Kernreaktoren ermöglichen. Die Immobilisierung des Mutternuklids mit folgender Elution des Tochternuklids in hoher Reinheit stellt hierbei das technische Fundament dar. Genauer zielen wir aus der Wiederaufbereitung von Uran, Thorium und nuklearem Abfall auf den Aufbau von ²²⁷Ac/²²⁷Th- und ²²⁷Th/²²³Ra-basierten Generatorsystemen ab, um relevante α-Emitter der Forschung einfacher verfügbar zu machen (Mehr hier).
Struktur-Funktions-Beziehungen
Struktur-Funktions-Beziehungen von Actiniden müssen erforscht werden, um deren magnetische, elektronische und (radio-)chemische Eigenschaften vorherzusagen. Mithilfe von Hochenergie-Röntgenabsorptionsspektroskopie (HR-XANES) und erweiterter Röntgenabsorptionsfeinstruktur (EXAFS) analysieren wir, in Zusammenarbeit mit dem Karlsruher Institut für Technologie (KIT), Pharmazeutika und Chelatbildner. Dichtefunktionaltheorie (DFT) und die Quantenmechanik der Atome in Molekülen (QTAIM) helfen uns, die Wechselwirkungen zwischen Metallionen und Liganden zu verstehen.
Radiomarkierte Substanzen für Diagnose und Therapie
Zur effektiven Diagnose und Therapie von Krebs sind neuartige oder optimierte radiomarkierte Liganden und Pharmazeutika unerlässlich. Unser Substanzdatenbank umfasst kleine und hybride Moleküle sowie Peptide und Peptidomimetika mit kürzerer oder längerer Retentionszeit, welche wir durch Methoden der klassischen organischen oder Festphasen-Synthese und Koordinationschemie erhalten, was entscheidend für unsere radiotheranostische Agenda ist (Mehr hier).
Multifunktionale Anorganisch-Organische Hybride Nanopartikel (IOH-NPs)
Das Rückstoßphänomen in Radiopharmazeutika mit α-Emittern beeinträchtigt deren Stabilität. Diesem Problem wollen wir mit dem neuen Konzept der Anorganisch-Organischen Hybriden Nanopartikel (IOH-NPs) begegnen, das von unseren Projektpartnern am Karlsruher Institut für Technologie (KIT) entwickelt wird. Solche Nanopartikel enthalten funktionale Anionen, die pharmazeutischen Eigenschaften verbessern können. IOH-NPs ermöglichen verschiedene Vorteile, wie z.B. hohe funktionale Beladungen, schnelle wasser-basierte Syntheseprozeduren, verbesserte Reproduzierbarkeiten.
Funktionale Alternativen
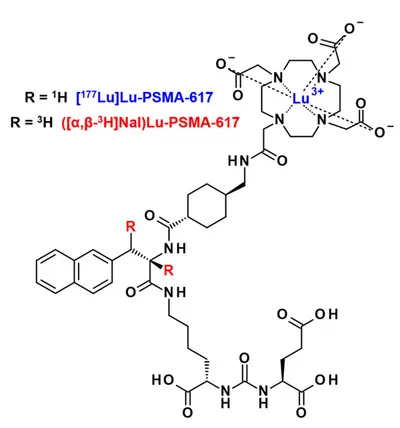
Wir erforschen die Anwendung funktioneller Alternativen zu radiometallbasierten Arzneimitteln für in vitro Entwicklungsphasen. Die realisieren wir z.B. durch robuste Tritium-Chemie und nicht-radioaktiver Metall-Substitute. Dies haben wir anhand des Isotopologs ([α,ß-³H]Nal)Lu-PSMA-617 erfolgreich bestätigt (Mehr hier). Diese Strategie lässt sich leicht auf andere Krebsziele und stellt für wissenschaftliche Einrichtungen eine sinnvolle Alternative dar, wenn kein Zugang zu klinisch relevanten Radiometallen möglich ist.
Arzneimittel-Transporter
Membrantransportproteine in verschiedenen Organen haben einen starken Einfluss auf die Absorption, Verteilung, den Metabolismus und die Exkretion (ADME) eingesetzter (Radio-)Pharmazeutika. Um unsere Wirkstoffentwicklung zielgerichtet zu optimieren, untersuchen wir die zugrundeliegenden Rezeptor-spezifischen und -unspezifischen Wechselwirkungen unserer eigens hergestellten (Radio-)Pharmazeutika (Mehr hier).
Resistenzentwicklung
In diesem Projekt werden kritische Gen-Expressionsmuster untersucht, die mit Behandlungsresistenz bei fortgeschrittenem Prostata- und Speicheldrüsenkrebs assoziiert sind. Unsere Daten beziehen wir hierbei aus Blut- und Gewebeproben von Patienten mit fortgeschrittener adenoid-zystischer (ACC), duktaler (SDC) und mukoepidermoider (MEC) Speicheldrüsenkarzinome, die sich einer zielgerichteter Alpha-Therapie (TαT) unterziehen. Die Studie zielt darauf ab personalisierte Prädiktionsmodelle für das Therapieansprechen zu entwickeln und potenzielle TαT-basierte Behandlungsalternativen für ACC-, SDC- und MEC-Patienten zu evaluieren, die Möglichkeiten der etablierten Behandlungsoptionen ausgereizt haben.
DNA-Schädigung und -Reparatur
Die Bewertung der α-Emitter-induzierten DNA-Schädigung und -Reparatur (DDR) Modulation birgt großes Potenzial für eine kombinierte (synergistische) TαT mit einem DDR-spezifischen Wirkstoff. Mit den Methoden der Durchflusszytometrie, Mikroskopie sowie protein- und DNA-basierten Assays wird die Induktion und Reparatur von Doppelstrangbrüchen (DSB) untersucht. Nachfolgend sollen diese Parameter in vivo validiert und charakterisiert werden, um kritische translationale Erkenntnisse zu gewinnen. Wir erwarten, dass diese kombinierte Behandlung herkömmliche Ansätze in Effizienz übertrifft und zu verbesserten Anti-Tumor-Effekten sowie verlängerter Remission bei Krebspatienten führt.
Spätfolgen
Patienten, die sich einer TαT unterziehen, zeigen oftmals schwere und akute Nebenwirkungen und aktuell unbekannte oder schwer vorhersagbare Spätfolgen. Mit dieser Studie wollen wir diese Wissenslücke schließen und die histologischen, pathogenen (Langzeit-)Veränderungen durch TαT in Mausmodellen untersuchen. Tumor- und gesundes Gewebe, das α-Emittern ausgesetzt war, wird mittels pathologischer Beurteilung, Multiplex-Immunhistochemie (mIHC) und MALDI-Bildgebung (MSI) evaluiert, um veränderte Proteinvorkommen zu identifizieren. Dieses tieferes Verständnis der zugrundeliegenden Pathomechanismen soll schützende Begleittherapien ermöglichen, um unerwünschte Nebenwirkungen zu beseitigen.
Unsere Meilensteine
Zwei unserer Mitglieder haben in der ehemaligen Abteilung für Radiopharmazeutische Chemie des DKFZ an der Entwicklung PSMA-zielgerichteter Verbindungen (PSMA-11, PSMA-617, PSMA-1007) mitgewirkt. PSMA-617 wurde von ABX (DE) lizenziert und im Jahr 2018 für 2.1 Milliarden US-Dollar von Novartis (CH) erworben.
2022 erhielt [¹⁷⁷Lu]Lu-PSMA-617 (Pluvicto®) die Zulassung von der FDA, MHRA, Health Canada und EMA zur Behandlung von metastasiertem Prostatakrebs: Ein globaler Erfolg. Unsere in-house entwickelten Produkte [⁶⁸Ga]Ga-PSMA-11 (Locametz®) und [¹⁸F]PSMA-1007 (Radelumin®) werden weltweit für die PET-Diagnostik von Prostatakrebs eingesetzt.
Diese Entwicklungen zeigen, dass unsere Forschung direkt zur Verbesserung der Patientenversorgung beiträgt, die wir neben Prostatakrebs erfolgreich auf andere Krebsarten übertragen möchten.

Das Team
Die Nachwuchsgruppe Translationale Radiotheranostik (früher: Molekulare Biologie systemischer Radiotherapie) wurde im April 2019 gegründet und vereint Forschende aus verschiedenen naturwissenschaftlichen Bereichen zur erfolgreichen Entwicklung neuer, verbesserter radiotheranostischer Konzepte.
-

Dr. Martina Benesova-Schäfer
Group Head
- Profil anzeigen

Sandra Casula
Administrative Assistentin für Abt. E041, E270 und E280
-

Mariam Amghar
PhD student
-
Ulrike Bauder-Wüst
Biologisch-Technische Assistentin (BTA)
-
Dr. Luciana Kovacs dos Santos
PostDoc - Translationale Radioonkologie
-

Dr. Harun Tas
PostDoc - Organische & Koordinationschemie
-

Ruth Winter
PhD student
-

Dr. Laurène Wagner
PostDoc - Radiochemie
Ausgewählte Publikationen
Schäfer M, Bauder-Wüst U, Roscher M, Motlová L, Kutilová Z, Remde Y, Klika KD, Graf J, Bařinka C, Benešová-Schäfer M*
Winter RC, Amghar M, Wacker AS, Bakos G, Taş H, Roscher M, Kelly JM, Benešová-Schäfer M*
Taş H, Bakos G, Bauder-Wüst U, Schäfer M, Remde Y, Roscher M, Benešová-Schäfer M*
Bauder-Wüst U, Schäfer M, Winter R, Remde Y, Roscher M, Breyl H, Poethko T, Tömböly C, Benešová-Schäfer M*
Kontaktieren Sie uns


